题目内容
Cu2O 是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为:2Cu+H2O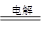 Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是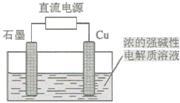
| A.石墨电极上产生氢气 |
| B.铜电极发生还原反应 |
| C.铜电极发生的电极反应为Cu—eˉ= Cu+ |
| D.当有0.2mol电子转移时,有0.1mol Cu2O生成 |
AD
解析试题分析:电解时阳极发生氧化反应,阴极发生还原反应;总反应式中铜元素由0升为+1价,氢元素由+1降为0价,Cu变为Cu2O是氧化反应,H2O变为H2是还原反应,由此可知,铜作阳极,石墨作阴极;根据电子、电荷、原子守恒原理,在浓的强碱性电解质溶液,阴极反应式为H2O+2eˉ=H2↑+2OHˉ,则石墨电极上产生氢气,故A项正确;阳极发生氧化反应,故B项错误;阳极反应式为Cu—2eˉ+2OHˉ=Cu2O+H2O,故C项错误;由于化合价升降总数等于转移电子数,则2Cu+H2O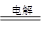 Cu2O+H2↑~2eˉ,该反应中氧化亚铜与转移电子的系数之比等于物质的量之比,当转移2mol电子时,有1molCu2O生成,则转移0.2mol电子时,有0.1molCu2O生成,故D项正确。
Cu2O+H2↑~2eˉ,该反应中氧化亚铜与转移电子的系数之比等于物质的量之比,当转移2mol电子时,有1molCu2O生成,则转移0.2mol电子时,有0.1molCu2O生成,故D项正确。
考点:考查电解原理及其应用,涉及电解总反应式、电解装置图、石墨和铜电极类型、电极反应类型、电极产物、电极反应式、转移电子与电极产物之间的计算等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下图为Mg—NaClO燃料电池结构示意图。下列说法正确的是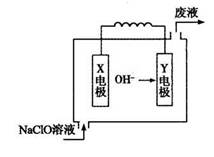
| A.镁作Y电极 |
| B.电池工作时Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
| D.X电极上发生的反应为:ClO—+2H2O—4e—=ClO3—+4H+ |
(2013茂名一模,11)研究小组分别用锌片、铝片、Cu和稀硫酸进行原电池的相关的探究,所得部分实验数据如下,下列说法正确的是
| 实验 | 电极甲 | 电极乙 |
| I | Zn | Cu |
| II | Al | Cu |
A.实验I中,甲电极反应为:2H++2eˉ=H2↑
B.实验II中,H+向Al定向迁移
C.两组实验溶液的pH均增大
D.实验II中,电子由铜转移到锌
关于下列装置说法正确的是 
| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.装置②工作一段时间后,a极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Sn,Sn为正极有气泡生成 |
下图所示装置中发生反应的离子方程式为:Zn + 2H+=Zn2+ + H2↑,下列说法错误的是
| A.a、b不可能是同种材料的电极 |
| B.该装置可能是电解池,电解质溶液为稀盐酸 |
| C.该装置可看作是铜一锌原电池,电解质溶液是稀硫酸 |
| D.该装置中通过2 mol电子,生成的气体在标况下的体积为22.4L |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
| A.a、b不连接时,只有锌片上有气泡逸出 |
| B.a和b用导线连接时,铜片上发生的反应为:2H+ + 2e-=H2 ↑ |
| C.a和b是否用导线连接,装置中所涉及的化学反应都相同 |
| D.a和b用导线连接或接直流电源,锌片都能溶解 |
下图是氢氧燃料电池构造示意图。下列说法不正确的是
| A.a极是负极 |
| B.电子由b通过灯泡流向a |
| C.该电池总反应是2H2+ O2= 2H2O |
| D.该装置可将化学能转化为电能 |
电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
