题目内容
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: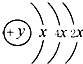 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:
(1)A的元素符号为
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为
(3)B和C最高价氧化物的水化物化学式分别为
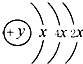 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:(1)A的元素符号为
Si
Si
,其气态氢化物的化学式为SiH4
SiH4
.(2)A、B、C、D四种元素的原子,半径由小到大的顺序为
N<P<Si<Mg
N<P<Si<Mg
(用元素符号表示).(3)B和C最高价氧化物的水化物化学式分别为
Mg(OH)2
Mg(OH)2
和HNO3
HNO3
.分析:第一电子层容纳2个电子,故x=2,则A的电子排布是2、8、4,为硅(Si);BC可形成离子化合物B3C2,B为金属,C为非金属,由化合物B3C2可知B显+2价,C显-3价,原子序数A>B,则B为Mg,C为N,C、D同主族,则D为P,据此解答.
解答:解:第一电子层容纳2个电子,故x=2,则A的电子排布是2、8、4,为硅(Si);BC可形成离子化合物B3C2,B为金属,C为非金属,由化合物B3C2可知B显+2价,C显-3价,原子序数A>B,则B为Mg,C为N,C、D同主族,则D为P,
(1)A为Si元素,其氢化物为SiH4,故答案为:Si;SiH4;
(2)同周期自左而右原子半径增大,同主族自上而下原子半径增大,则原子半径N<P<Si<Mg,
故答案为:N<P<Si<Mg;
(3)B为Mg,对应的最高价氧化物的水化物为Mg(OH)2,C为N元素,对应的最高价氧化物的水化物为HNO3,
故答案为:Mg(OH)2;HNO3.
(1)A为Si元素,其氢化物为SiH4,故答案为:Si;SiH4;
(2)同周期自左而右原子半径增大,同主族自上而下原子半径增大,则原子半径N<P<Si<Mg,
故答案为:N<P<Si<Mg;
(3)B为Mg,对应的最高价氧化物的水化物为Mg(OH)2,C为N元素,对应的最高价氧化物的水化物为HNO3,
故答案为:Mg(OH)2;HNO3.
点评:本题考查位置结构性质的相互关系,题目难度中等,注意根据化合物B3C2判断元素的化合价并根据原子序数关系判断元素的种类.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比3:4,D分别与A、B、C可形成10个电子的分子X、Y、Z.则下列叙述正确的是( )
| A、X、Y、Z三种分子的稳定性逐渐减弱 | B、上述四种元素共能形成五种单质 | C、X、Y、Z三种分子的沸点逐渐升高 | D、X、Y、Z三种分子均为极性分子 |

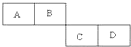 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.