题目内容
现有部分前36号元素的性质或原子结构如下表:
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是____________________________________。
R原子的结构示意图是 。
(2)S元素的最常见化合价为________,原因是________________________________________。
(3)T元素原子的价电子构型为________。
(4)X的电子排布图违背了____________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:_________________________________。
| 元素编号 | 元素性质或原子结构 |
| R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| T | 基态原子3d轨道上有1个电子 |
| X |  |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是____________________________________。
R原子的结构示意图是 。
(2)S元素的最常见化合价为________,原因是________________________________________。
(3)T元素原子的价电子构型为________。
(4)X的电子排布图违背了____________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:_________________________________。
(1)原子的2p轨道半充满,能量低,稳定 (2分)示意图略(1分)
(2)-1(1分) F的电负性最大,只能得电子(2分) (3)3d14s2(1分)
(4)能量最低原理(1分)电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量(2分)
(2)-1(1分) F的电负性最大,只能得电子(2分) (3)3d14s2(1分)
(4)能量最低原理(1分)电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量(2分)
试题分析:基态原子的最外层有3个未成对电子,次外层有2个电子,这说明R是第二周期元素,则R是氮元素;单质能与水剧烈反应,所得溶液呈弱酸性,则S是F元素;基态原子3d轨道上有1个电子,则根据构造原理可知,T是21号元素钪元素;X的核外电子数是12个,实验X是Mg元素。
(1)由于氮元素原子的2p轨道半充满,能量低,稳定性强,所以氮元素的第一电离能要大于其同周期相邻的元素。氮元素是第二周期第ⅤA族元素,所以R原子的结构示意图是
 。
。(2)由于F的电负性最大,属于第ⅦA族元素,只能得到1个电子,所以常见化合价是-1价。
(3)根据构造原理可知钪元素原子的价电子构型为3d14s2。
(4)由于3s能级的能量低于3p能级的能量,所以核外电子首先排满3s,然后在排3p能级。因此根据
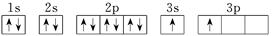 可知,电子排布图违背了能量最低原理。由于电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以碱金属盐及碱土金属盐等可以做成焰火。
可知,电子排布图违背了能量最低原理。由于电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以碱金属盐及碱土金属盐等可以做成焰火。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)