题目内容
下列关于粒子结构的描述不正确的是( )
| A.H2S和NH3均是价电子总数为8的极性分子 |
| B.HS-和HCl均是含有一个极性键的18电子粒子 |
| C.CH2Cl2和CCl4均是四面体构型的非极性分子 |
D.1 mol 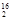 DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值) DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值) |
C
试题分析:H2S中H、S元素形成的极性键,但结构不对称,属于极性分子;NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,也属于极性分子,故A正确;HS-和HCl都只含一个极性键,都具有18个电子,故B正确;CH2C12正负电荷的中心不重合,是极性分子,故C错误;1 mol D216O中含中子、质子、电子分别为10 NA,故D正确;故选。

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
 溶液作电解质
溶液作电解质