题目内容
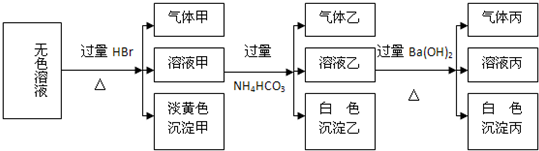
某无色溶液,其中可能存在Na+、Ba2+、AlO2-、S2-、SO32-、SO42-.取该溶液进行有关实验,实验结果如图所示.
请回答下列问题:
(1)由溶液甲生成沉淀乙的离子方程式为______;
(2)沉淀丙中一定含有______(填化学式,下同),可能含有______;
(3)综合上述信息,该溶液中肯定存在的离子有______.
解:(1)只有Al3+和HCO3-之间能发生双水解反应生成Al(OH)3白色沉淀,即Al3++3HCO3-=Al(OH)3↓+3CO2↑,但是Al3+和S2-不共存,所以Al3+是AlO2-和盐酸反应后得到的,溶液中一定含有AlO2-,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(2)过量的碳酸氢铵和氢氧化钡反应一定会生成一定量的碳酸钡,硫酸根存在时,也会和钡离子反应生成硫酸钡沉淀,所以沉淀丙可能是BaCO3或 BaCO3和BaSO4的混合物,
故答案为:BaCO3;BaSO4;
(3)可以确定溶液中一定含有AlO2-、S2-、SO32-,根据溶液的电中性原理,一定得含有阳离子,而溶液不含有Ba2+,一定含有钠离子,故答案为:AlO2-、S2-、SO32-、Na+.
分析:无色溶液加入过量盐酸生成淡黄色沉淀,该沉淀只能为S,说明溶液中S2-、SO32-在酸性环境下发生归中反应生成淡黄色的沉淀单质硫,即2S2-+SO32-+6H+=3S↓+3H2O,溶液甲加入碳酸氢铵生成白色沉淀和气体,只有Al3+和HCO3-之间能发生双水解反应生成Al(OH)3白色沉淀,即Al3++3HCO3-=Al(OH)3↓+3CO2↑,但是Al3+和S2-不共存,所以Al3+是AlO2-和盐酸反应后得到的,溶液中一定含有AlO2-,则不含有Ba2,以此解答该题.
点评:本题考查常见离子的检验及离子组成分的确定,题目难度中等,注意常见离子的检验方法,把握有关离子的性质,会书写反应的离子的方程式.
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(2)过量的碳酸氢铵和氢氧化钡反应一定会生成一定量的碳酸钡,硫酸根存在时,也会和钡离子反应生成硫酸钡沉淀,所以沉淀丙可能是BaCO3或 BaCO3和BaSO4的混合物,
故答案为:BaCO3;BaSO4;
(3)可以确定溶液中一定含有AlO2-、S2-、SO32-,根据溶液的电中性原理,一定得含有阳离子,而溶液不含有Ba2+,一定含有钠离子,故答案为:AlO2-、S2-、SO32-、Na+.
分析:无色溶液加入过量盐酸生成淡黄色沉淀,该沉淀只能为S,说明溶液中S2-、SO32-在酸性环境下发生归中反应生成淡黄色的沉淀单质硫,即2S2-+SO32-+6H+=3S↓+3H2O,溶液甲加入碳酸氢铵生成白色沉淀和气体,只有Al3+和HCO3-之间能发生双水解反应生成Al(OH)3白色沉淀,即Al3++3HCO3-=Al(OH)3↓+3CO2↑,但是Al3+和S2-不共存,所以Al3+是AlO2-和盐酸反应后得到的,溶液中一定含有AlO2-,则不含有Ba2,以此解答该题.
点评:本题考查常见离子的检验及离子组成分的确定,题目难度中等,注意常见离子的检验方法,把握有关离子的性质,会书写反应的离子的方程式.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目