题目内容
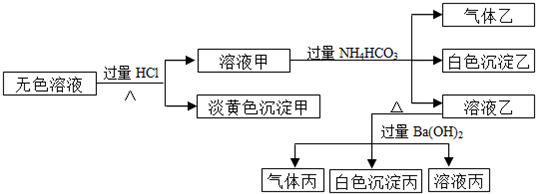
某无色溶液,其中可能存在的离子有:Na+、Ag+、Fe3+、Ba2+、Al3+、AlO2-、S2-、SO32-、SO42-,现取该溶液进行实验,实验结果如下:
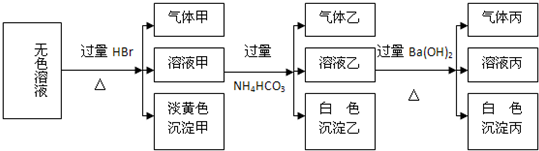
(1)生成沉淀甲的离子方程式为
(2)由溶液甲生成沉淀乙的离子方程式为
(3)沉淀丙可能是
(4)综合上述信息,可以肯定存在的离子有

(1)生成沉淀甲的离子方程式为
2S2-+SO42-+6H+=3S↓+3H2O
2S2-+SO42-+6H+=3S↓+3H2O
(2)由溶液甲生成沉淀乙的离子方程式为
Al3++3HCO3-=Al(OH)3↓+3CO2↑
Al3++3HCO3-=Al(OH)3↓+3CO2↑
(3)沉淀丙可能是
BaCO3或BaCO3和BaSO4
BaCO3或BaCO3和BaSO4
(填化学式)(4)综合上述信息,可以肯定存在的离子有
AlO2-、S2-、SO32-、Na+
AlO2-、S2-、SO32-、Na+
.分析:(1)硫离子和亚硫酸根离子在酸性环境下发生归中反应生成单质硫;
(2)铝离子和碳酸氢根之间能发生双水解反应生成氢氧化铝白色沉淀;
(3)碳酸根、硫酸根均能和钡离子反应生成白色沉淀;
(4)根据离子共存和离子反应来确定存在的离子.
(2)铝离子和碳酸氢根之间能发生双水解反应生成氢氧化铝白色沉淀;
(3)碳酸根、硫酸根均能和钡离子反应生成白色沉淀;
(4)根据离子共存和离子反应来确定存在的离子.
解答:解:(1)根据所给的离子,硫离子和亚硫酸根离子在酸性环境下发生归中反应生成淡黄色的沉淀单质硫,即2S2-+SO32-+6H+=3S↓+3H2O,故答案为:2S2-+SO32-+6H+=3S↓+3H2O;
(2)只有铝离子和碳酸氢根之间能发生双水解反应生成氢氧化铝白色沉淀氢氧化铝,即Al3++3HCO3-=Al(OH)3↓+3CO2↑,但是铝离子和硫离子不共存,所以该铝离子是偏铝酸根离子和氢溴酸反应后得到的铝离子,溶液中一定含有偏铝酸根,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)过量的碳酸氢铵和氢氧化钡反应一定会生成一定量的碳酸钡,硫酸根存在时,也会和钡离子反应生成硫酸钡沉淀,所以沉淀丙可能是BaCO3或 BaCO3和BaSO4的混合物,
故答案为:BaCO3或BaCO3和BaSO4;
(4)根据以上三小题,可以确定溶液中一定含有AlO2-、S2-、SO32-,根据溶液的电中性原理,一定得含有阳离子,而溶液是无色的,所以不含有三价铁离子,一定含有钠离子,
故答案为:AlO2-、S2-、SO32-、Na+.
(2)只有铝离子和碳酸氢根之间能发生双水解反应生成氢氧化铝白色沉淀氢氧化铝,即Al3++3HCO3-=Al(OH)3↓+3CO2↑,但是铝离子和硫离子不共存,所以该铝离子是偏铝酸根离子和氢溴酸反应后得到的铝离子,溶液中一定含有偏铝酸根,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)过量的碳酸氢铵和氢氧化钡反应一定会生成一定量的碳酸钡,硫酸根存在时,也会和钡离子反应生成硫酸钡沉淀,所以沉淀丙可能是BaCO3或 BaCO3和BaSO4的混合物,
故答案为:BaCO3或BaCO3和BaSO4;
(4)根据以上三小题,可以确定溶液中一定含有AlO2-、S2-、SO32-,根据溶液的电中性原理,一定得含有阳离子,而溶液是无色的,所以不含有三价铁离子,一定含有钠离子,
故答案为:AlO2-、S2-、SO32-、Na+.
点评:本题考查常见离子的检验及离子组成分的确定,题目难度中等,注意常见离子的检验方法,把握有关离子的性质,会书写反应的离子的方程式.

练习册系列答案
相关题目