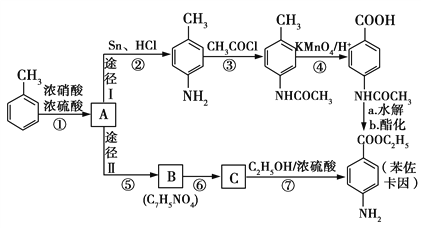
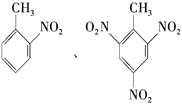
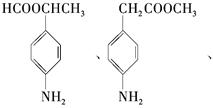
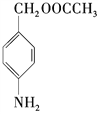
��Ŀ����
����Ŀ�����������£��赥�ʺ�HCl��Ӧ����SiHCl3�Ǵֹ��ᴿ����Ҫ���裮ijС�������ͼ��ʾװ���������ת�����г�װ����ȥ���� 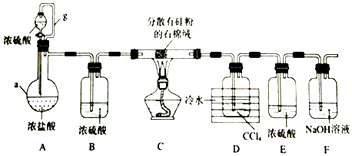
��֪��SiHCl3�ķе�Ϊ33.0��C���������л��ܼ�������ˮ���ҷ�Ӧ���ڿ������ױ�������CCl4�ķе�Ϊ76.8��C��
��ش�
��1������a������������g��������
��2��װ��A�У�Ũ�������ֵ�����Ϊ��ʵ��ʱ�����ȴ�Һ©��������һ��ʱ����ڵ�ȼC���ƾ��ƣ���������
��3��װ��C�з�����Ӧ�Ļ�ѧ����ʽΪ��
��4��װ��D�����õ�Һ̬�����ķ��뷽��Ϊ �� ����������ƣ�
��5����Ӧ�������ͨ��װ��F�е�NaOH��Һ���ݳ�����Ĵ�������Ϊ��
��6��SiHCl3�ڳ�ʪ�Ŀ����б�����������һ���������һ�������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ
���𰸡�
��1��������ƿ��ƽ��ѹǿ��ʹŨ�������μӣ������������𰸣�
��2����ˮ�ԣ��ž�װ���еĿ���������SiHCl3������е�ˮ������Ӧ�ͱ�O2����
��3��Si+3HCl ![]() SiHCl3+H2
SiHCl3+H2
��4������
��5����ȼ���������ռ���
��6��2SiHCl3+O2+2H2O�T2SiO2+6HCl
���������⣺��1������a�Ǿ���֧�ܵ���ƿ��Ϊ������ƿ��װ��A�е�b������Ϊ��ƽ��ѹǿ�����ã�ʹ��Һ©���е�Һ��Ũ����˳�����£�
�ʴ�Ϊ��������ƿ��ƽ��ѹǿ��ʹŨ�������μӣ������������𰸣�����2��װ��A��������ƿ��ʢ��Ũ���ᣬ��Һ©����ʢ��Ũ���ᣬ����Ũ�������ˮ���Լ��Ȼ���Ļӷ��ԣ���Һ©����������A���ų��Ȼ������壬SiHCl3�ķе�Ϊ33.0��C���������л��ܼ�������ˮ���ҷ�Ӧ���ڿ������ױ�������ʵ��ʱ�����ȴ�Һ©��������һ��ʱ����ڵ�ȼC���ƾ��ƣ��ž�װ���еĿ���������SiHCl3������е�ˮ������Ӧ�ͱ�O2������
�ʴ�Ϊ����ˮ�ԣ� �ž�װ���еĿ���������SiHCl3������е�ˮ������Ӧ�ͱ�O2��������3�����������Ϣ���赥�ʺ�HCl��Ӧ����SiHCl3��֪������Ȼ��ⷴӦ�ķ���ʽΪ��Si+3HCl ![]() SiHCl3+H2 ��
SiHCl3+H2 ��
�ʴ�Ϊ��Si+3HCl ![]() SiHCl3+H2����4��SiHCl3�ķе�Ϊ33.0��C���������л��ܼ����Ƴ���SiHCl3���ܲ������ᴿSiHCl3�ķ�����������е�ϵͣ�ͨ������ķ�������õ�������SiHCl3 ��
SiHCl3+H2����4��SiHCl3�ķе�Ϊ33.0��C���������л��ܼ����Ƴ���SiHCl3���ܲ������ᴿSiHCl3�ķ�����������е�ϵͣ�ͨ������ķ�������õ�������SiHCl3 ��
�ʴ�Ϊ������5���赥�ʺ�HCl��ӦSi+3HCl ![]() SiHCl3+H2 �� �ֹ������HCl���巴Ӧ�Ƶ�SiHCl3��Si+3HCl
SiHCl3+H2 �� �ֹ������HCl���巴Ӧ�Ƶ�SiHCl3��Si+3HCl ![]() SiHCl3+H2��װ��F�е�����������Ϊ�����չ������Ȼ��⣬ͨ��װ��F��ʣ������Ϊ����������ȼ������ˮ����ͨ����ȼ�������ռ�������
SiHCl3+H2��װ��F�е�����������Ϊ�����չ������Ȼ��⣬ͨ��װ��F��ʣ������Ϊ����������ȼ������ˮ����ͨ����ȼ�������ռ�������
�ʴ�Ϊ����ȼ���������ռ�������6������ȶ�������Ϊ�������裬SiHCl3�ڳ�ʪ�Ŀ����б�����������һ��������Ϊ�������裬����ԭ���غ��֪һ��������Ϊ�Ȼ��⣬���Ը÷�Ӧ�Ļ�ѧ����ʽΪ��2SiHCl3+O2+2H2O�T2SiO2+6HCl��
�ʴ�Ϊ��2SiHCl3+O2+2H2O�T2SiO2+6HCl��
�ֹ��ᴿ��װ��A��������ƿ��ʢ��Ũ���ᣬ��Һ©����ʢ��Ũ���ᣬ����Ũ�������ˮ���Լ��Ȼ���Ļӷ��ԣ���Һ©����������A���ų��Ȼ������壬�ž�װ���еĿ�����װ��B�����Ȼ���������и��װ��C���ֹ������HCl���巴Ӧ�Ƶ�SiHCl3��Si+3HCl ![]() SiHCl3+H2��װ��F�е�����������Ϊ�����չ������Ȼ��⣬װ��E��ֹF�е�ˮ��������װ��D��SiHCl3������Ӧ��װ��D�ռ�SiHCl3 �� ͨ��װ��F��ʣ������Ϊ��������ͨ����ȼ�������ռ������� ��1����������a�������Լ��������������ƽ��װ��A�е�b������Ϊ��ƽ��ѹǿ�����ã���2��Ũ���������ˮ�ԣ��Ȼ����ӷ���SiHCl3����ˮ���ҷ�Ӧ���ڿ������ױ���������3������Ȼ����ڼ��ȵ������·�Ӧ���ɺ����ȹ������������4���õ��IJ���е㲻ͬ�����Կ��Ʒе�ͨ������ķ����õ�SiHCl3����5����Ӧ�������Ϊ�������������пɿ�ȼ�ԣ���ͨ��ȼ�ջ������ռ��ķ�������β������6��SiHCl3�ڳ�ʪ�Ŀ����б�����������һ��������Ϊ�������裬һ�����������ԭ���غ��֪Ϊ�Ȼ��⣮
SiHCl3+H2��װ��F�е�����������Ϊ�����չ������Ȼ��⣬װ��E��ֹF�е�ˮ��������װ��D��SiHCl3������Ӧ��װ��D�ռ�SiHCl3 �� ͨ��װ��F��ʣ������Ϊ��������ͨ����ȼ�������ռ������� ��1����������a�������Լ��������������ƽ��װ��A�е�b������Ϊ��ƽ��ѹǿ�����ã���2��Ũ���������ˮ�ԣ��Ȼ����ӷ���SiHCl3����ˮ���ҷ�Ӧ���ڿ������ױ���������3������Ȼ����ڼ��ȵ������·�Ӧ���ɺ����ȹ������������4���õ��IJ���е㲻ͬ�����Կ��Ʒе�ͨ������ķ����õ�SiHCl3����5����Ӧ�������Ϊ�������������пɿ�ȼ�ԣ���ͨ��ȼ�ջ������ռ��ķ�������β������6��SiHCl3�ڳ�ʪ�Ŀ����б�����������һ��������Ϊ�������裬һ�����������ԭ���غ��֪Ϊ�Ȼ��⣮

����Ŀ��Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�pH��Fe2+Ũ�ȵķ�ˮ�м���H2O2 �� ���������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p��CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�죮[ʵ�����]����p��CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±�����������¶Ա����飮
��1�����������ʵ����Ʊ������в�Ҫ���ո�
ʵ���� | ʵ��Ŀ�� | T/K | pH | c/10��3molL��1 | |
H2O2 | Fe2+ | ||||
�� | Ϊ����ʵ�����ο� | 298 | 3 | 6.0 | 0.30 |
�� | ̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� | ||||
�� | 298 | 10 | 6.0 | 0.30 | |
��2��[���ݴ���]ʵ����p��CP��Ũ����ʱ��仯�Ĺ�ϵ��ͼ��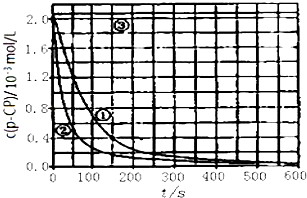
�������ͼʵ������ߣ����㽵�ⷴӦ��50��150s�ڵķ�Ӧ���ʣ�v��p��CP��= ��
��3��[���������]ʵ��١��ڱ����¶����ߣ����ⷴӦ���������¶ȹ���ʱ�������½��ⷴӦ���ʼ�С�����Fenton�������Լ�H2O2�ĽǶȷ���ԭ�� ��
��4��ʵ��۵ó��Ľ����ǣ�pH����10ʱ�� ��
��5���������⣺��һ��������H2O2��Fe2+�����ӷ�Ӧʽ ��