题目内容
【题目】用NA表示阿伏加德罗常数的值。下列说法中正确的是
A.2.4g金属镁变成镁离子时失去的电子数为0.1NA
B.标况下,mg气体A与ng气体B的分子数相同,则A、B两气体的密度之比为n∶m
C.含有NA个氦原子的氦气的体积约为11.2L
D.1.7gOH-中所含的电子数为NA
【答案】D
【解析】
A.2.4g镁的物质的量为0.1mol,而镁变为镁离子时失去2个电子,故0.1mol镁失去0.2NA个电子,故A错误;
B.标准状况下,分子数相同的气体A和B,根据n=![]() 可知二者的物质的量相同,依据pV=nRT,n=
可知二者的物质的量相同,依据pV=nRT,n=![]() ,可知pM=ρRT,可知同温同压下,A、B两气体的密度之比等于其摩尔质量之比=m:n,故B错误;
,可知pM=ρRT,可知同温同压下,A、B两气体的密度之比等于其摩尔质量之比=m:n,故B错误;
C.氦气的状态条件未知,不能利用气体摩尔体积计算体积,故C错误;
D.一个OH-中含有10个电子,1.7g氢氧根离子的物质的量为0.1mol,含有1mol电子,所含的电子数为NA,故D正确;
答案选D。

练习册系列答案
相关题目
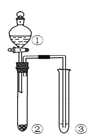
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D