题目内容
【题目】下列说法正确的是
A.常温下,0.1mol·L-1某一元酸(HA)溶液中 ,加入少量NaA晶体或加水稀释,溶液中c(OH-)均增大
,加入少量NaA晶体或加水稀释,溶液中c(OH-)均增大
B.已知:0.1mol·L-1KHC2O4溶液呈酸性,则存在关系:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)>c(H+)>c(OH-)
C.25℃,H2SO3![]() HSO3—+H+的电离常数Ka=1×10-2mol·L-1,该温度下NaHSO3水解反应的平衡常数Kh=1×10-12mol·L-1
HSO3—+H+的电离常数Ka=1×10-2mol·L-1,该温度下NaHSO3水解反应的平衡常数Kh=1×10-12mol·L-1
D.0.1mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
【答案】C
【解析】
A.根据 ,
,![]() ,可计算出c(H+)=0.1mol/L,说明该一元酸为强酸,加入少量NaA晶体时,溶液中c(OH-)不变,加水稀释,溶液中c(H+)减小,则c(OH-)增大,A项错误;
,可计算出c(H+)=0.1mol/L,说明该一元酸为强酸,加入少量NaA晶体时,溶液中c(OH-)不变,加水稀释,溶液中c(H+)减小,则c(OH-)增大,A项错误;
B.KHC2O4溶液呈酸性,说明HC2O4-电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),B项错误;
C.NaHSO3水解方程式为:HSO3-+H2O![]() H2SO3+OH-,其水解平衡常数Kh=
H2SO3+OH-,其水解平衡常数Kh=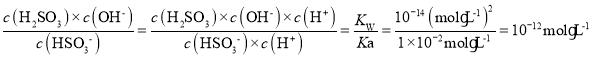 ,C项正确;
,C项正确;
D.NaHSO4是强酸的酸式盐,在水溶液中完全电离,故0.1mol·L-1NaHSO4溶液中根据电荷守恒有:c(Na+)+c(H+)=2c(SO42-)+c(OH-),D项错误;
答案选C。

练习册系列答案
相关题目
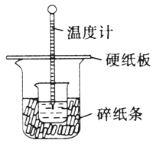
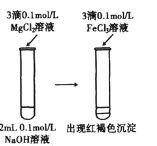
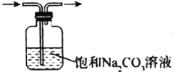
【题目】利用下列实验装置能完成相应实验的是
选项 | 装置图 | 实验目的 |
A |
| 收集干燥的HCl |
B |
| 除去CO2中含有的少量HCl |
C |
| 收集H2、NH3、CO2、Cl2、HCl、NO、NO2等气体 |
D |
| 检查装置的气密性 |
A.AB.BC.CD.D