题目内容
化学学习中,推理是一种重要的学习方法,下列推论正确的是( )
| A、由“BF3和SO3互为等电子体”,可推知二者均为非极性分子 |
| B、由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
| C、由“蒸干NaCl溶液得NaCl固体”,可推知蒸干MgCl2溶液得MgCl2固体 |
| D、由“同温度下等浓度的Na2CO3溶液比Na2SO3溶液的pH大”,可推知C比S的非金属性弱 |
考点:“等电子原理”的应用,非金属在元素周期表中的位置及其性质递变的规律,极性分子和非极性分子,盐类水解的应用
专题:基本概念与基本理论
分析:A.等电子体具有相似的结构;
B.化学变化的本质是旧键的断裂和新键的形成;
C.NaCl不水解,MgCl2能水解;
D.根据盐类水解规律,越弱越水解以及元素的非金属性越强,对应最高价氧化物的水化物的酸性越强.
B.化学变化的本质是旧键的断裂和新键的形成;
C.NaCl不水解,MgCl2能水解;
D.根据盐类水解规律,越弱越水解以及元素的非金属性越强,对应最高价氧化物的水化物的酸性越强.
解答:
解:A.等电子体具有相似的结构,BF3为非极性分子,“BF3和SO3互为等电子体”,故SO3为非极性分子,故A正确;
B.化学变化的本质是旧键的断裂和新键的形成,由“某过程发生化学键断裂”,不一定该过程发生了化学变化,故B错误;
C.NaCl不水解,所以蒸干NaCl溶液得NaCl固体,MgCl2能水解,所以蒸干MgCl2溶液得氢氧化镁固体,故C错误;
D.同温度下等浓度的Na2CO3溶液比Na2SO3溶液的pH大,则酸性:H2CO3<H2SO3,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,所以不能比较C比S的非金属性弱,故D错误;
故选A.
B.化学变化的本质是旧键的断裂和新键的形成,由“某过程发生化学键断裂”,不一定该过程发生了化学变化,故B错误;
C.NaCl不水解,所以蒸干NaCl溶液得NaCl固体,MgCl2能水解,所以蒸干MgCl2溶液得氢氧化镁固体,故C错误;
D.同温度下等浓度的Na2CO3溶液比Na2SO3溶液的pH大,则酸性:H2CO3<H2SO3,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,所以不能比较C比S的非金属性弱,故D错误;
故选A.
点评:本题考查推理这种学习方法,难度不大.要注意推理必须在具有相同性质的物质间进行.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
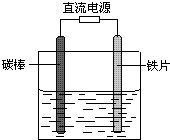 如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象.下列叙述正确的是( )
如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象.下列叙述正确的是( )| A、碳棒接直流电源的负极 |
| B、碳棒上发生还原反应 |
| C、铁片上的电极反应式为2Cl--2e-═Cl2↑ |
| D、铁片附近出现的浑浊物是Mg(OH)2 |
在一定温度下,向足量的饱和CuSO4溶液中加入16g无水CuSO4,搅拌后静置,最终所得晶体的质量( )
| A、等于16g |
| B、大于16g而小于25g |
| C、等于25g |
| D、大于25g |
现已查明非典型肺炎属于急性呼吸道传染病,其病原体是冠状病毒的一种变种.阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构式为:
 .
.
有关阿昔洛韦的结构及性质错误的叙述是( )
 .
.有关阿昔洛韦的结构及性质错误的叙述是( )
| A、分子中所有原子可能在同一平面内 |
| B、该物质在一定条件下可发生消去反应 |
| C、该物质在一定条件下可发生取代反应 |
| D、该物质不属于芳香族化合物 |
H2CO3和H2S在25℃时的电离常数如下:则下列反应可能发生的是( )
| 电离常数 | K1 | K2 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
| H2S | 5.7×10-8 | 1.2×10-15 |
| A、NaHCO3+NaHS=Na2CO3+H2S |
| B、H2S+2Na2CO3=Na2S+2NaHCO3 |
| C、Na2S+H2O+CO2=NaHS+NaHCO3 |
| D、H2S+NaHCO3=NaHS+H2CO3 |
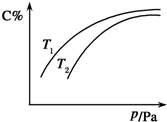 在密闭容器中,对于可逆反应A(?)+3B(?)═2C(g)△H<0,平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
在密闭容器中,对于可逆反应A(?)+3B(?)═2C(g)△H<0,平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )| A、当n(A):n(B):n(c)=1:3:2时,反应达到平衡状态 |
| B、A、B聚集状态均无法确定 |
| C、压强增大时,混合气体的平均相对分子质量增大 |
| D、其他条件不变,升高温度,反应的平衡常数增大 |
氨气溶于水达平衡后,若只改变某一条件,下列说法正确的是( )
A、继续通入氨气,
| ||
| B、NH4Cl水解显酸性,所以向溶液中加入NH4Cl固体,会促进NH3?H2O电离 | ||
| C、向溶液加入HCl气体,则一定有[NH4+]=[Cl-] | ||
| D、实验室中可以通过将浓氨水加入到碱石灰中来制取氨气 |
科学家用NaNO3和Na2O在一定条件下化合制得由钠离子和阴离子B构成的晶体NaxNO4,测定阴离子B中的各原子的最外层电子都达到了8电子稳定结构.下列说法错误的是( )
| A、x=3 |
| B、N的化合价为+3 |
C、阴离子B的电子式可能为 |
| D、此反应是非氧化还原反应 |