题目内容
19.降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在一定体积的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.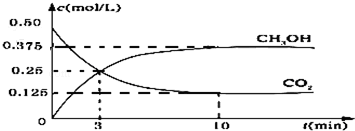
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=0.1125mol/(L•min);
(2)氢气的转化率=75%;
(3)下列措施中能使平衡体系中$\frac{n(C{H}_{3}OH)}{n({H}_{2})}$减小的是CD.
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1molH2
(4)下列不能表示反应达到平衡状态的是BE
A.体系压强不再改变 B.混合气体的密度不再改变
C.容器内的温度不再改变 D.混合气体的平均分子质量不再改变
E.V(CO2):V(H2O)=1:1 F 混合气体的总物质的量不再改变.
分析 (1)由图可知,10min到达平衡时△c(CH3OH)=0.375mol/L,由方程式可知△c(H2)=3△c(CH3OH),根据v=$\frac{△c}{△t}$计算v(H2);
(2)根据二氧化碳起始浓度、起始物质的量计算容器体积,再根据△n=△c•V计算△n(H2),进而是氢气转化率;
(3)使平衡体系中$\frac{n(C{H}_{3}OH)}{n({H}_{2})}$减小,可以使平衡逆向移动,注意不能增大甲醇或降低氢气的量,也可能增大氢气的量,使平衡正向移动;
(4)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.
解答 解:(1)由图可知,10min到达平衡时△c(CH3OH)=0.75mol/L,由方程式可知△c(H2)=3△c(CH3OH)=0.375mol/L×3=1.125mol/L,故v(H2)$\frac{1.125mol/L}{10min}$=0.1125mol/(L•mon),
故答案为:0.1125mol/(L•mon);
(2)容器的容积为$\frac{1mol}{0.5mol/L}$=2L,故△n(H2)=2L×1.125mol/L=2.25mol,则氢气转化率为$\frac{2.25mol}{3mol}$×100%=75%,
故答案为:75%;
(3)A.将H2O(g)从体系中分离,平衡向正反应移动,比值增大,故A错误;
B.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,比值不变,故B错误;
C.该反应正反应是放热反应,升高温度平衡向逆反应移动,比值减小,故C正确;
D.再充入1molH2,平衡向正反应移动,但平衡时氢气物质的量增大、二氧化碳物质的量减小,比值减小,故D正确,
故选:CD;
(4)A.反应前后气体物质的量发生变化,容器内压强变化,体系压强不再改变说明到达平衡,故A正确;
B.混合气体总质量不变,容器容积不变,混合气体的密度始终不变,故B错误;
C.容器内的温度不再改变,说明反应物的量不再变化,反应到达最大限度,到达平衡状态,故C正确;
D.反应前后气体物质的量发生变化,混合气体总质量不变,随反应进行平均相对分子质量变化,混合气体的平均分子质量不再改变说明到达平衡,故D正确;
E.未指明正逆速率,不能说明到达平衡,若分别表示正、逆速率,则反应到达平衡,故E错误;
F.随反应进行混合气体总物质的量发生变化,混合气体的总物质的量不再改变,说明到达平衡,故F正确,
故选:BE.
点评 本题考查化学平衡计算与影响因素、平衡状态判断、反应速率计算等,题目难度中等,(3)中注意学生容易只考虑逆向移动,忽略增大氢气正向移动情况.

| A. | 1molNO的质量是30g | |
| B. | 标准状况下,1molH2O的体积是22.4L | |
| C. | 17gNH3含有的氢原子总数为6.02×1023 | |
| D. | 100mL0.1mol/L Na2CO3溶液中,Na+的物质的量为 0.01mol |
| A. | 中子数为18的硫原子:$\frac{18}{16}$S | B. | CS2分子的电子式: | ||
| C. | 硫离子(S2-)的结构示意图: | D. | 苯磺酸的结构简式: |
| A. | 对硝基苯酚的结构简式: | B. | 甲烷的比例模型: | ||
| C. | 甲基的电子式: | D. | 葡萄糖的实验式:CH2O |
| A. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA | |
| B. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| C. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 数目为NA的一氧化碳分子和0.5mol甲烷的质量比为7:4 |