题目内容
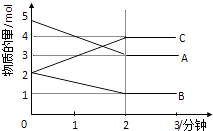
【题目】常温下,将1.92g铜加入到100ml H2SO4和HNO3的混合液中,Cu全部溶解,放出无色气体,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气.下列有关结论不正确的是( )
A.溶解的铁粉为2.8g
B.原溶液中c(SO42﹣)=0.5mol/L
C.原混合溶液中c(H+)=1.2mol/L
D.原溶液中n(NO3﹣)=0.08mol
【答案】D
【解析】解:常温下,将铜加入到H2SO4和HNO3的混合液中,发生反应3Cu+8H++2NO3﹣=3Cu2++2NO↑+3H2O,Cu全部溶解,放出无色气体为NO,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448ml(标准状况)的氢气,说明硫酸有剩余,硝酸全部起氧化剂作用.加入的铁发生反应Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2++H2↑,置换出溶液中的铜、与氢气.A、由离子方程式可知n(Fe)=n(Cu)+n(H2)= ![]() +
+ ![]() =0.05mol,所以加入铁粉的质量为0.05mol×56g/mol=2.8g,故A正确;
=0.05mol,所以加入铁粉的质量为0.05mol×56g/mol=2.8g,故A正确;
B、加入足量铁粉后的溶液中溶质是硫酸亚铁,根据硫酸根守恒n(H2SO4)=n(FeSO4)=0.05mol,所以原溶液中c(SO42﹣)= ![]() =0.5mol/L,故B正确;
=0.5mol/L,故B正确;
C、n(Cu)= ![]() =0.03mol,根据3Cu+8H++2NO3﹣=3Cu2++2NO↑+3H2O可知,参加反应的氢离子的物质的量为0.03mol×
=0.03mol,根据3Cu+8H++2NO3﹣=3Cu2++2NO↑+3H2O可知,参加反应的氢离子的物质的量为0.03mol× ![]() =0.08mol,n(H2)=
=0.08mol,n(H2)= ![]() =0.02mol,剩余的氢离子的物质的量为0.02mol×2=0.04mol,所以原混合溶液中c(H+)=
=0.02mol,剩余的氢离子的物质的量为0.02mol×2=0.04mol,所以原混合溶液中c(H+)= ![]() =1.2mol/L,故C正确;
=1.2mol/L,故C正确;
D、n(Cu)= ![]() =0.03mol,根据3Cu+8H++2NO3﹣=3Cu2++2NO↑+3H2O可知,原溶液中n(NO3﹣)=
=0.03mol,根据3Cu+8H++2NO3﹣=3Cu2++2NO↑+3H2O可知,原溶液中n(NO3﹣)= ![]() ×0.03mol=0.02mol,故D错误.
×0.03mol=0.02mol,故D错误.
故选:D.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案