��Ŀ����
����Ŀ���̷���FeSO47H2O��������ȱ����ƶѪ����Чҩ��ij��ѧ��ȤС����̷����������µ�̽����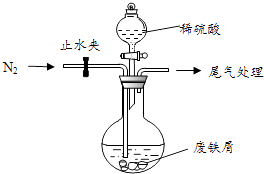
��1�����Ʊ���Ʒ��
��С���ɷ���м������������ͭ�������������ʣ�������ͼ��ʾװ���Ʊ�FeSO47H2O���壬�������£�
��Ԥ�������Ƚ�����м���뵽����Na2CO3��Һ��ϴ�ӣ�Ŀ���� �� Ȼ����м��ˮϴ��2��3�飮
�ڽ�ϴ�Ӻ�ķ���м���뵽Բ����ƿ�У�������ͨ��N2 �� N2�������� ��
���ټ�������ϡ���ᣬ�����¶�50�桫80��֮�䣬��ַ�Ӧ��Բ����ƿ��ʣ��Ĺ���Ϊ ��
�ܻ�ȡ��Ʒ�������裨3���з�Ӧ��Ļ�����м�����������ˮ�����ȹ��ˣ� �� �� �˳����壬��������ˮϴ��2��3�Σ�������ֽ���������ɣ��ܱձ��森
��2�����ⶨFeSO47H2O������
�ٳ�ȡ������Ʒ10.0g������������ϡ�����У����100mL��Һ����Ҫ����������ƽ����ͷ�ιܡ��ձ�����Ͳ�⣬����Ҫ�������У����������ƣ��� �� ��ͷ�ιܣ�250ml����ƿ��
��ȷ��ȡ25mL��Һ������ƿ�У���0.1000mol/L KMnO4����Һ�ζ�����ζ��յ���жϷ����� ��
����ͬ���ķ����ζ�3�Σ�ƽ������10.00mL��Һ������Ʒ��FeSO47H2O����������Ϊ �� ����֪Mr��FeSO47H2O��=278��
�����������ƫС����������ڶ���ʱ������ӡ������ӡ���������
���𰸡�
��1��ϴȥ��м��������ۣ��ų�װ���еĿ�����������Cu����ȴ���ᾧ
��2��100mL����ƿ���������������һ�α�Һ����ʱ����Һ��Ϊ�Ϻ�ɫ����30s���ֲ��䣻55.6%������
���������⣺��1����̼���Ƶ�ˮ��Һ�Լ��ԣ����Գ�ȥ��м��������ۣ����Դ��ǣ�ϴȥ��м��������ۣ���FeSO4�ױ���������������ͨ��N2�ų�װ���еĿ��������������Դ��ǣ��ų�װ���еĿ�����������������ͭ�������������ᷴӦ��������ͭ����������������������ͭ����������Ӧ��������������ͭ���ʣ����Դ��ǣ�Cu����ϴ�ӡ����ˡ���ȴ�ᾧ�ɵ�FeSO47H2O���壬���Դ��ǣ���ȴ���ᾧ����2���ٲ���Ϊ���������������Һ��ת�ơ�ϴ�ӡ����ݡ�ҡ�ȡ�װƿ����ǩ����Ҫʹ�õ������У�100mL ����ƿ��������ƽ���ձ�������������ͷ�ιܣ���Ͳ���ÿɲ��ã����Դ��ǣ�100mL ����ƿ�����������ڿ�����KMnO4��Һ��������ɫ��Ϊָʾ���жϵζ��յ�ʱ���ٵμ�KMnO4��Һʱ����Һ������ɫ��Ϊ�Ϻ�ɫ�����Դ��ǣ������һ�α�Һ����ʱ����Һ��Ϊ�Ϻ�ɫ����30s���ֲ��䣻�۲ⶨ��Ʒ��Fe2+�ĺ���������������������KMnO4��Һ�ζ���Fe2+��Fe3+ �� ��Ԫ�ػ��ϼ�����1�ۣ�MnO4����Mn2+ �� ��Ԫ�ؽ���5�ۣ����ϼ�������С������Ϊ5����Fe2+ϵ��Ϊ5��MnO4�� ϵ��Ϊ1������Ԫ���غ��֪Mn2+��Fe3+ϵ���ֱ�Ϊ1��5�����ݵ���غ��֪ȱ��ΪH+ �� H+��ϵ��Ϊ2+3��5��[2��5��1]=8������HԪ���غ��֪H2Oϵ����4�����Է�Ӧ���ӷ���ʽΪ5Fe2++MnO4��+8H+=1Mn2++5Fe3++4H2O��
��Fe2+�����ʵ���Ϊxmol����
5Fe2+������������MnO4�� ��
5 1
xmol 0.01L��0.1mol/L
����x= ![]() =0.005mol��
=0.005mol��
������Ʒ��FeSO47H2O������0.005mol��4��278g/mol=5.56g������4g��Ʒ��FeSO47H2O����������Ϊ ![]() ��100%=55.6%��
��100%=55.6%��
���Դ��ǣ�55.6%���ܶ���ʱ�������ƫ��Ũ��ƫС�����Դ��ǣ����ӣ�

 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д� �ľ�ͼ���ʱ�ȷ�ϵ�д�
�ľ�ͼ���ʱ�ȷ�ϵ�д�