题目内容
15.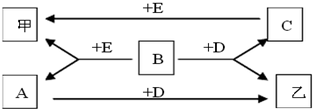 已知甲、乙两种白色固体都不溶于水不溶于稀硝酸,A、B、C、D、E 均是能溶于水的化合物.
已知甲、乙两种白色固体都不溶于水不溶于稀硝酸,A、B、C、D、E 均是能溶于水的化合物.通过上述信息,写出下列物质化学式 ABa(NO3)2BBaCl2CNaClDNa2SO4EAgNO3.
分析 甲、乙两种白色固体都不溶于水不溶于稀硝酸,分别为AgCl、BaSO4中的一种,其它均是能溶于水的化合物,若甲为AgCl,则乙为BaSO4,而B与E反应生成AgCl,B与D反应生成BaSO4,则B为BaCl2,E为AgNO3,A为Ba(NO3)2,D为Na2SO4等,C为NaCl,符合题意,若甲为BaSO4,则乙为AgCl,则B为BaCl2,D为AgNO3,C为Ba(NO3)2,E为Na2SO4等,A为NaCl,符合题意,据此解答.
解答 解:甲、乙两种白色固体都不溶于水不溶于稀硝酸,分别为AgCl、BaSO4中的一种,其它均是能溶于水的化合物,若甲为AgCl,则乙为BaSO4,而B与E反应生成AgCl,B与D反应生成BaSO4,则B为BaCl2,E为AgNO3,A为Ba(NO3)2,D为Na2SO4等,C为NaCl,符合题意,若甲为BaSO4,则乙为AgCl,则B为BaCl2,D为AgNO3,C为Ba(NO3)2,E为Na2SO4等,A为NaCl,符合题意,
故答案为:Ba(NO3)2;BaCl2;NaCl;Na2SO4;AgNO3.
点评 本题考查无机物推断,关键是确定甲、乙两分别为AgCl、BaSO4中的一种,再结合整个关系推断,注意答案的不唯一性.

练习册系列答案
相关题目
5.工业上合成氨的反应:N2(g)+3H2(g)═2NH3(g)△H=-92.60kJ•mol-1.
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g),下列说法能说明上述反应向正反应方向进行的是②④(填序号).
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N-H键的同时生成2n mol H-H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2h时放出的热量为27.66 kJ.
②此温度下该反应的化学平衡常数K=0.15(保留两位小数).
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”或“不移动”).
④有甲、乙两个完全相同的容器,向甲容器中加入1mol N2 (g)和6mol H2 (g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2mol NH3 (g)和3mol H2 (g),达到平衡时的热效应(放热或吸热)为4Q.则甲容器中H2的转化率为10%.
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g),下列说法能说明上述反应向正反应方向进行的是②④(填序号).
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N-H键的同时生成2n mol H-H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
①反应进行到2h时放出的热量为27.66 kJ.
②此温度下该反应的化学平衡常数K=0.15(保留两位小数).
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”或“不移动”).
④有甲、乙两个完全相同的容器,向甲容器中加入1mol N2 (g)和6mol H2 (g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2mol NH3 (g)和3mol H2 (g),达到平衡时的热效应(放热或吸热)为4Q.则甲容器中H2的转化率为10%.
3.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 22.4 LCl2分别与铁和铜反应时,失电子数目均为NA | |
| B. | 1mol Na2O2与CO2足量反应时,转移NA个电子 | |
| C. | 1mol•L-1的NaOH溶液中含Na+数目为NA | |
| D. | 1mol Na2O2晶体中含有的阴离子数目为2NA |
20.下列实验操作中正确的是( )
| A. | 用浓硫酸配制稀硫酸时,浓硫酸缓慢加入水中,并用玻璃棒不断搅拌 | |
| B. | 用酒精和汽油都可以萃取碘水中的碘 | |
| C. | 潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 | |
| D. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
4.下列各组物质之间不可能实现如图所示转化的是 ( )


| 选项 | X | Y | Z | M |
| A | O2 | CO2 | CO | C |
| B | HNO3 | Fe(NO3)3 | Fe(NO3)2 | Fe |
| C | NaOH | NaHCO3 | Na2CO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
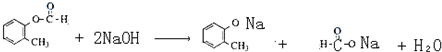
 C6H5COOCH3+H2O.
C6H5COOCH3+H2O.
 .
.