题目内容
【题目】水的电离平衡曲线如图所示:
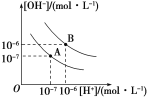
(1)若以A点表示25 ℃时水电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到________。
(2)将pH=8的氢氧化钡溶液与pH=5的盐酸溶液混合并保持100 ℃恒温,欲使混合溶液的pH=7,则氢氧化钡溶液与盐酸的体积比为________。
(3)已知AnBm的离子积K=[Am+]n·[Bn-]m,在某温度下,氢氧化钙溶解度为0.74 g,其饱和溶液密度设为1 g·cm-3,其离子积为K=________。
【答案】1×10-141×10-122∶90.004
【解析】
(1)由水的离子积定义式和图中氢离子和氢氧根离子的浓度可知A到B,水的离子积从1×10-14 变化到1×10-12;(2)设氢氧化钡溶液和盐酸的体积分别为Vb、Va,(10-12/10-8Vb-10-5Va)/(Va+Vb)=10-12/10-7,Vb/Va=2∶9,故答案为2∶9;(3)因为氢氧化钙的溶解度为0.74 g,所以该温度下1 000 g饱和氢氧化钙溶液含氢氧化钙质量为7.4 g,氢氧化钙物质的量为0.1 mol,即[Ca2+]=0.1 mol·L-1,[OH-]=0.2 mol·L-1,所以K=[Ca2+]·[OH-]2=0.004,故答案为:0.004。

练习册系列答案
相关题目
【题目】下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A | B | C | D |
配制1mol/L AlCl3溶液 | 实验室制取 氢气 | 比较硫、碳、硅三种 元素的非金属性强弱 | 盛装NaOH 溶液 |
|
|
|
|
A. AB. BC. CD. D