��Ŀ����
����Ŀ��ijѧϰС��̽��Ũ��ϡ���������Ե����ǿ��������ͼװ�ý������飨�г���������ȥ����ʵ�����Ũ�����ܽ�NO������NO2����ϡ���������NO���ɴ˵ó��Ľ�����Ũ�����������ǿ��ϡ������
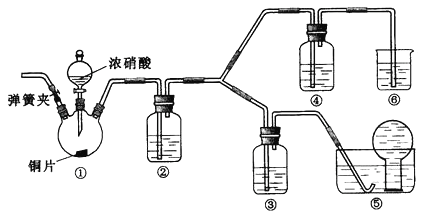
��ѡҩƷ��Ũ���ᡢ3mol/Lϡ���ᡢ����ˮ��Ũ���ᡢ����������Һ��������̼
��֪������������Һ����NO��Ӧ������NO2��Ӧ![]()
��1��ʵ��Ӧ�����к������ŷŵ������У�װ�â�����������ʢ�ŵ�ҩƷ������_________
��2���μ�Ũ����֮ǰ�IJ����Ǽ���װ�õ������ԣ�����ҩƷ�����ɼк�_________
��3��װ�â��з�����Ӧ�Ļ�ѧ����ʽ��__________
��4��װ�âڵ�������_________��������Ӧ�Ļ�ѧ����ʽ��___________
��5����С��ó��Ľ��������ݵ�����������____________
��6�����������ͬѧ�Ƿ���װ�â�����Һ����ɫ����������ɫ����ͬѧ��Ϊ�Ǹ���Һ������ͭ�����������ϸ����£�����ͬѧ��Ϊ�Ǹ���Һ���ܽ������ɵ����塣ͬѧ�Ƿֱ����������3��ʵ�����ж����ֿ����Ƿ���ȷ����Щ�����п��е���___��ѡ�������ĸ��
a.���ȸ���ɫ��Һ���۲���ɫ�仯
b.��ˮϡ����ɫ��Һ���۲���ɫ�仯
c.������ͭ��Һ��ͨ��Ũ������ͭ��Ӧ���������壬�۲���ɫ�仯
���𰸡� 3mol/Lϡ���ᡢŨ���ᡢ����������Һ ͨ��CO2һ��ʱ�䣬�رյ��ɼУ���װ�â��е���ĩ�����뵹�õ���ƿ�� Cu + 4HNO3��Ũ��= Cu(NO3)2 + 2NO2�� + 2H2O ��NO2ת��ΪNO 3NO2 + H2O =2HNO3 + NO װ�â���Һ���Ϸ�������Ϊ��ɫ��װ�â���Һ���Ϸ���������ɫ��Ϊ����ɫ ac
��������(1)����װ���ص��ʵ��Ŀ�ģ�װ�â����ռ�NO��װ�â���ʢ��NaOH��Һ����NO2��ֹ��Ⱦ��������ΪҪ��֤ϡHNO3��������NO������װ�â���Ӧ��ʢ��ϡ���ᣮ
�ʴ�Ϊ��3mol/Lϡ���ᡢŨ���ᡢ����������Һ��
(2)����װ���вд�Ŀ���������NO����ʵ��������ţ����Եμ�ŨHNO3֮ǰ��Ҫͨ��һ��ʱ��CO2����װ���еĿ�����ͬʱҲ�轫װ�â��е���ĩ�����뵹�õ���ƿ�ڷ�ֹ��Ӧ������NO�����ݳ����ʴ�Ϊ��ͨ��CO2һ��ʱ�䣬�رյ��ɼУ���װ�â��е���ĩ�����뵹�õ���ƿ�ڣ�
(3)Cu��ŨHNO3��Ӧ����Cu(NO3)2��NO2��H2O���ʴ�Ϊ��Cu+4HNO3(Ũ)=Cu(NO3)2+2NO2��+2H2O��
(4)װ�â���ʢ��H2O��ʹNO2��H2O��Ӧ����NO��3NO2+H2O=2HNO3+NO���ʴ�Ϊ����NO2ת��ΪNO�� 3NO2+H2O=2HNO3+NO��
(5)NOͨ��ϡHNO3��Һ��������ɫNO2������˵��ϡHNO3��������NO������ʢ��ϡHNO3װ�õ�Һ���Ϸ�û����ɫ�仯����˵����װ�â���ʢ�ŵ���ŨHNO3����ŨHNO3������NO��װ�â�Һ����Ϸ����������ɫ���壬�ʴ�Ϊ��װ�â���Һ���Ϸ�������Ϊ��ɫ��װ�â���Һ���Ϸ���������ɫ��Ϊ����ɫ��
(6)Ҫ֤����Cu(NO3)2Ũ�ȹ������ܽ���NO2����װ�â�����Һ����ɫ��һ�ǿ���ƽ��ܽ��NO2����(a����)�ٹ۲���ɫ�仯������������Һ��NO2Ũ��(c����)��ͨ���۲���ɫ�仯�����ж�����ѡa c���ʴ�Ϊ��a c��

 ��У����ϵ�д�
��У����ϵ�д�

