��Ŀ����
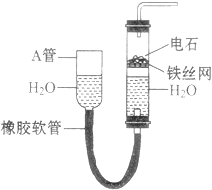
����Ŀ���뵼�������г���Ҫ���Ʋ��ӣ��Ա�֤���Ƶ����ʣ����Ȼ��ף�PCl3����һ����Ҫ�IJ��Ӽ���ʵ����Ҫ�û��ף������ף�������Cl2ģ�ҵ������ȡPCl3 �� װ����ͼ��ʾ�������ּг�װ����ȥ��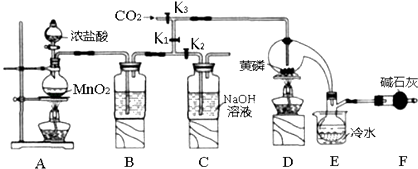
��֪����������Cl2��Ӧ����PCl3 �� �����Cl2��Ӧ����PCl5 PCl3��ˮ��ǿ��ˮ���� �� H3PO3��HC1����O2������P0Cl3 �� P0Cl3����PCl3 �� PCl3��POCl3���۷е���±���
���� | �۵�/�� | �е�/�� |
PCl3 | ��112 | 75.5 |
POCl3 | 2 | 105.3 |
��ش��������⣺
��1��Aװ���������������ӷ���ʽΪ ��
��2��B����װ�Լ��� �� E����ˮ��������F�м�ʯ�ҵ�������
��3��ʵ��ʱ�����װ�������Ժ��ȴ�K3ͨ������CO2 �� ��Ѹ�ټ�����ף�ͨ����CO2�������� ��
��4���ֲ�Ʒ�г�����POCl3��PCl5�ȣ���������ȳ�ȥPCl5��ͨ������ʵ��������ƣ������ɵõ��ϴ�����PCl3 ��
��5��ͨ�����淽���ɲⶨ��Ʒ��PCl3����������
��Ѹ�ٳ�ȡ1.00g��Ʒ����ˮ��Ӧ�����250mL��Һ��
��ȡ������Һ25.00mL�������м���10.00mL0.1000molL��1��ˮ����ַ�Ӧ��
�����������Һ�м��뼸�ε�����Һ����0.1000molL��1��Na2S2O3 �� ��Һ�ζ�
���ظ��ڡ��۲�����ƽ������Na2S2O3 �� ��Һ8.40ml
��֪��H3PO3+H2O+I2�TH3PO4+2HI��I2+2Na2S2O3�T2NaI+Na2S4O6 �� ����ⶨ������û��������Ӧ�������������ݣ��ò�Ʒ��PC13����������Ϊ ��
���𰸡�
��1��MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O
Mn2++Cl2��+2H2O
��2��ŨHSO4������PCl3��ֹ��ӷ������ն������������ֹ�����е�ˮ��PCl3��Ӧ
��3���ž�װ���еĿ�������ֹ������ȼ
��4������
��5��79.75%
���������⣺��1��װ��A�з����ķ�Ӧ��MnO2+4HCl ![]() MnCl2+Cl2��+2H2O������д�ɵã�MnO2+4H++2Cl��
MnCl2+Cl2��+2H2O������д�ɵã�MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O�����Դ��ǣ�MnO2+4H++2Cl��
Mn2++Cl2��+2H2O�����Դ��ǣ�MnO2+4H++2Cl�� ![]() Mn2++Cl2��+2H2O����2����ֹ���ɵ�PC13ˮ�⣬�μӷ�Ӧ����������Ҫ���������Bװ����ʢװ��Ũ�������������E����ˮӦ���ǽ��µģ��ٽ����ƿ���ռ���PC13�ӷ�����֪��ˮ����ˮ������PC13 �� ���ӷ���ʵ���ж���������ж������ֱ���ŷŻ���Ⱦ�������������������ˮ������ƿ���ᵼ��PC13ˮ�⣬��ϼ�ʯ�ҵ����ʿ�֪������β��������ͬʱ��ֹ�����е�ˮ��������ƿ�����Դ��ǣ�ŨHSO4������PCl3��ֹ��ӷ������ն������������ֹ�����е�ˮ��������ƿ��PC13��Ӧ����3����������������ȼ����Ҫ�ų�װ���еĿ�������ͨ��ͨ���CO2�ﵽĿ�ģ����Դ��ǣ��ž�װ���еĿ�������ֹ������ȼ����4��POCl3��PCl3�۷е�������ԵIJ��죬��ȥPC13�л��е�POCl3 �� ��ѡ������ķ�ʽ���з��룬�Եõ�������PC13 �� ���Դ��ǣ�����5���ζ�ʵ���漰��ϵʽΪPCl3��H3PO3��I2��2Na2S2O3��I2 �� ��������PC13�����ʵ���Ϊnmol��ˮ�����ɵ�H3PO3��Ӧ����I2�����ʵ���Ϊnmol���ζ�����I2�����ĵ�Na2S2O3�����ʵ���Ϊ0.1000molL��1��8.40��10��3L=8.4��10��4mol�������I2�����ʵ���Ϊ
Mn2++Cl2��+2H2O����2����ֹ���ɵ�PC13ˮ�⣬�μӷ�Ӧ����������Ҫ���������Bװ����ʢװ��Ũ�������������E����ˮӦ���ǽ��µģ��ٽ����ƿ���ռ���PC13�ӷ�����֪��ˮ����ˮ������PC13 �� ���ӷ���ʵ���ж���������ж������ֱ���ŷŻ���Ⱦ�������������������ˮ������ƿ���ᵼ��PC13ˮ�⣬��ϼ�ʯ�ҵ����ʿ�֪������β��������ͬʱ��ֹ�����е�ˮ��������ƿ�����Դ��ǣ�ŨHSO4������PCl3��ֹ��ӷ������ն������������ֹ�����е�ˮ��������ƿ��PC13��Ӧ����3����������������ȼ����Ҫ�ų�װ���еĿ�������ͨ��ͨ���CO2�ﵽĿ�ģ����Դ��ǣ��ž�װ���еĿ�������ֹ������ȼ����4��POCl3��PCl3�۷е�������ԵIJ��죬��ȥPC13�л��е�POCl3 �� ��ѡ������ķ�ʽ���з��룬�Եõ�������PC13 �� ���Դ��ǣ�����5���ζ�ʵ���漰��ϵʽΪPCl3��H3PO3��I2��2Na2S2O3��I2 �� ��������PC13�����ʵ���Ϊnmol��ˮ�����ɵ�H3PO3��Ӧ����I2�����ʵ���Ϊnmol���ζ�����I2�����ĵ�Na2S2O3�����ʵ���Ϊ0.1000molL��1��8.40��10��3L=8.4��10��4mol�������I2�����ʵ���Ϊ ![]() =0.00042mol���ṩI2�������ʵ���Ϊ0.1000molL��1��10.0��10��3L=1.0��10��3mol����H3PO3��Ӧ����I2�����ʵ���nmol=1.0��10��3mol��0.00042mol=0.00058mol��25ml��Һ�ﺬ��PC13������Ϊ0.00058mol��137.5gmol��1=0.07975g����Ʒ��PC13����������Ϊ
=0.00042mol���ṩI2�������ʵ���Ϊ0.1000molL��1��10.0��10��3L=1.0��10��3mol����H3PO3��Ӧ����I2�����ʵ���nmol=1.0��10��3mol��0.00042mol=0.00058mol��25ml��Һ�ﺬ��PC13������Ϊ0.00058mol��137.5gmol��1=0.07975g����Ʒ��PC13����������Ϊ ![]() ��100%=79.75%�����Դ��ǣ�79.75%��
��100%=79.75%�����Դ��ǣ�79.75%��

����Ŀ������̼ѭ��������������ҵĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����Ϊ��ѧ���о�����Ҫ���⣮
��1������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO��g��+H2O��g��
CO2��g��+H2��g�����õ������������ݣ�
ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
��ʵ��2������ƽ�ⳣ��K= ��
��ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ�������� ![]() ��ֵ�������ֵ��ȡֵ��Χ����
��ֵ�������ֵ��ȡֵ��Χ����
��ʵ��4����900��ʱ���ڴ������м���CO��H2O��CO2��H2��Ϊ1mol�����ʱV�� V���������������������=������
��2����֪�ڳ��³�ѹ�£�д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=��1275.6kJ/mol
��2CO��g��+O2��g��=2CO2��g����H=��566.0kJ/mol
��H2O��g��=H2O��l����H=��44.0kJ/mol
��3����֪������һ�ֶ�Ԫ���ᣬ�������ƣ�NaHC2O4����Һ�����ԣ������£���10mL 0.01molL��1 H2C2O4��Һ�еμ�10mL 0.01molL��1 NaOH��Һʱ���Ƚ���Һ�и�������Ũ�ȵĴ�С��ϵ��
��4��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10��9 �� CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mol/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ mol/L��
��5���Զ����ѣ�CH3OCH3����������H2SO4Ϊԭ�ϣ���Ϊ�缫�ɹ���ȼ�ϵ�أ��乤��ԭ�������ȼ�ϵ�ص�ԭ�����ƣ���д���õ�ظ����ϵĵ缫��Ӧʽ�� ��