��Ŀ����
����Ŀ�������Ԫ�����ڱ���һ���֣��������е���ĸ�ֱ����һ�ֻ�ѧԪ�أ� 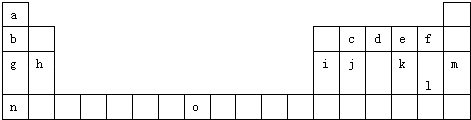
�Իش��������⣺
��1����д����ĸO����Ԫ�ص���Χ�����Ų� ��
��2����jԭ�Ӹ�cԭ����1��1������϶��γɵľ��壬�����뾧��j��ͬ����������۵���ߵ������ѧʽ�����Դӽṹ�Ƕȼ��Խ��ͣ� ��
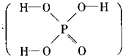
��3���������еļ���Ϊ �� ���ӵĿռ�ṹΪ �� ÿ��Pԭ������Pԭ�ӽ�ϳɹ��ۼ�������1���Ӱ����е�����P��P����������һ����ԭ�ӣ����ɽ������ԭ�ӣ���ÿ��Pԭ���ϵŶԵ���������ԭ����λ���Ϳ��Եõ�����һ���������������ʽ����
��4��i���ʾ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ���侧����������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ����ͼ����ʾ�� 
����֪i��ԭ�Ӱ뾶Ϊd��NA���������ӵ�������i�����ԭ������ΪM����ش�
��i���ʾ�����ԭ�ӵĶѻ���ʽΪ������iԭ�ӵ���λ��Ϊ �� һ��������iԭ�ӵ���ĿΪ__��
�ڸþ�����ܶ�Ϊ������ĸ��ʾ����
���𰸡�
��1��3d64s2
��2��SiC����SiC�����뾧��Si����ԭ�Ӿ��壬����C��ԭ�Ӱ뾶С��SiC��C��Si�������Ⱦ���Si��Si��Si�����̣����ܴ�����۷е��
��3��60�㣻�������壻3��6��P4O10
��4�����������ѻ���12��4��![]()
���������⣺��1����Ԫ���������ڱ��е�λ�ÿ�֪��Oλ�ڵ������ڢ������һ�У�OΪFe����Χ�����Ų�ʽ3d64s2 �� ���Դ��ǣ�3d64s2��
��2.��SiC�;���Si������ԭ�Ӿ��壬ԭ�Ӿ�����۷е�ȡ���ڹ��ۼ���ǿ�ȣ�����Cԭ�Ӱ뾶С��SiC��C��Si�������Ⱦ���Si��Si��Si�����̣����ܴ�����۷е�ߣ����Դ��ǣ�SiC�� ��SiC�����뾧��Si����ԭ�Ӿ��壬����C��ԭ�Ӱ뾶С��SiC��C��Si�������Ⱦ���Si��Si��Si�����̣����ܴ�����۷е�ߣ�
��3.������Ϊ������������ṹ������Ϊ60�㣬ÿ��Pԭ����3��Pԭ�ӽ�ϳɹ��ۼ���ÿ�������к���6�����ۼ�������1���Ӱ����е�����P��P����������һ����ԭ�ӣ����ɽ��6��Oԭ�ӣ���ÿ��Pԭ���ϵŶԵ��ӷֱ�������λ������һ����ԭ�ӣ����ɽ��4��Oԭ�ӣ�����γɻ�����P4O10 �� ���Դ��ǣ�60�㣻�������壻3��6��P4O10��
��4.���ٸ���ͼƬ֪��Al����Ϊ���������ѻ���Alԭ����λ����λ��=3�� ![]() ��8=12����ͼ2��֪ռ�ݶ�������ģ������Ϊ8��
��8=12����ͼ2��֪ռ�ݶ�������ģ������Ϊ8�� ![]() +6��
+6�� ![]() =4�����Դ��ǣ����������ѻ���12��4��
=4�����Դ��ǣ����������ѻ���12��4��
��Alԭ�Ӱ뾶Ϊd�����߳�=2 ![]() d���������V=��2
d���������V=��2 ![]() d��3 �� ÿ��������Alԭ�Ӹ���Ϊ4�����ܶ�Ϊ�ѣ�
d��3 �� ÿ��������Alԭ�Ӹ���Ϊ4�����ܶ�Ϊ�ѣ� ![]() =
= ![]() ����æ�=
����æ�= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��

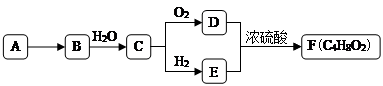
����Ŀ���뵼�������г���Ҫ���Ʋ��ӣ��Ա�֤���Ƶ����ʣ����Ȼ��ף�PCl3����һ����Ҫ�IJ��Ӽ���ʵ����Ҫ�û��ף������ף�������Cl2ģ�ҵ������ȡPCl3 �� װ����ͼ��ʾ�������ּг�װ����ȥ��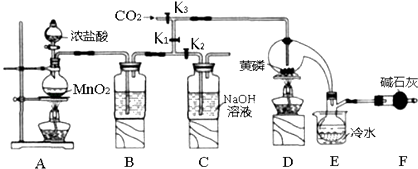
��֪����������Cl2��Ӧ����PCl3 �� �����Cl2��Ӧ����PCl5 PCl3��ˮ��ǿ��ˮ���� �� H3PO3��HC1����O2������P0Cl3 �� P0Cl3����PCl3 �� PCl3��POCl3���۷е���±���
���� | �۵�/�� | �е�/�� |
PCl3 | ��112 | 75.5 |
POCl3 | 2 | 105.3 |
��ش��������⣺
��1��Aװ���������������ӷ���ʽΪ ��
��2��B����װ�Լ��� �� E����ˮ��������F�м�ʯ�ҵ�������
��3��ʵ��ʱ�����װ�������Ժ��ȴ�K3ͨ������CO2 �� ��Ѹ�ټ�����ף�ͨ����CO2�������� ��
��4���ֲ�Ʒ�г�����POCl3��PCl5�ȣ���������ȳ�ȥPCl5��ͨ������ʵ��������ƣ������ɵõ��ϴ�����PCl3 ��
��5��ͨ�����淽���ɲⶨ��Ʒ��PCl3����������
��Ѹ�ٳ�ȡ1.00g��Ʒ����ˮ��Ӧ�����250mL��Һ��
��ȡ������Һ25.00mL�������м���10.00mL0.1000molL��1��ˮ����ַ�Ӧ��
�����������Һ�м��뼸�ε�����Һ����0.1000molL��1��Na2S2O3 �� ��Һ�ζ�
���ظ��ڡ��۲�����ƽ������Na2S2O3 �� ��Һ8.40ml
��֪��H3PO3+H2O+I2�TH3PO4+2HI��I2+2Na2S2O3�T2NaI+Na2S4O6 �� ����ⶨ������û��������Ӧ�������������ݣ��ò�Ʒ��PC13����������Ϊ ��