题目内容
【题目】“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题.
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K= .
②实验3中,若平衡时,CO的转化率大于水蒸气,则 ![]() 的值(填具体值或取值范围).
的值(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 V逆(填“<”,“>”,“=”).
(2)已知在常温常压下:写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=﹣566.0kJ/mol
③H2O(g)=H2O(l)△H=﹣44.0kJ/mol
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01molL﹣1 H2C2O4溶液中滴加10mL 0.01molL﹣1 NaOH溶液时,比较溶液中各种离子浓度的大小关系;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10﹣9 . CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10﹣4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 mol/L.
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似.请写出该电池负极上的电极反应式: .
【答案】
(1)![]()
或0.17;<1(填0<a/b<1亦可);<
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8 kJ∕mol
(3)c(Na+)>c(HC2O4﹣)>c(H+)>c(C2O42﹣)>c(OH﹣)
(4)5.6×10﹣5
(5)CH3OCH3﹣12e﹣+3H2O=3CO2+12H+
【解析】解:(1)①平衡时c(CO)= ![]() =0.8mol/L,c(H2)=
=0.8mol/L,c(H2)= ![]() =0.2mol/L,c(H2O)=
=0.2mol/L,c(H2O)= ![]() =0.6mol/L,c(CO2)=c(H2)=
=0.6mol/L,c(CO2)=c(H2)= ![]() =0.2mol/L,化学平衡常数K=
=0.2mol/L,化学平衡常数K= ![]() =
= ![]() =
= ![]() 或0.17,故答案为:
或0.17,故答案为: ![]() 或0.17;②根据方程式知,参加反应的CO的物质的量等于生成氢气的物质的量,所以a﹣d=c,若平衡时,CO的转化率大于水蒸气,则
或0.17;②根据方程式知,参加反应的CO的物质的量等于生成氢气的物质的量,所以a﹣d=c,若平衡时,CO的转化率大于水蒸气,则 ![]() ,
, ![]() =1,其转化率大于0,所以0<
=1,其转化率大于0,所以0< ![]() =1,故答案为:<1 (填0<a/b<1亦可);③c(CO)=c(H2)=c(H2O)=c(CO2)=
=1,故答案为:<1 (填0<a/b<1亦可);③c(CO)=c(H2)=c(H2O)=c(CO2)= ![]() =0.5mol/L,浓度商=
=0.5mol/L,浓度商= ![]() =1>K,说明平衡向逆反应方向移动,则V正<V逆 , 故答案为:<;(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1275.6kJ/mol②2CO(g)+O2(g)=2CO2(g)△H=﹣566.0kJ/mol③H2O(g)=H2O(l)△H=﹣44.0kJ/mol将方程式
=1>K,说明平衡向逆反应方向移动,则V正<V逆 , 故答案为:<;(2)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1275.6kJ/mol②2CO(g)+O2(g)=2CO2(g)△H=﹣566.0kJ/mol③H2O(g)=H2O(l)△H=﹣44.0kJ/mol将方程式 ![]() +2③得CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=
+2③得CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H= ![]() +2×(﹣44.0kJ/mol)=﹣442.8 kJ∕mol,故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8 kJ∕mol; (3)二者恰好反应生成草酸氢钠,草酸氢钠溶液呈酸性c(H+)>c(OH﹣),则草酸氢根离子电离和水电离都生成氢离子,草酸氢根离子水解和电离程度较小,所以离子浓度大小顺序是c(Na+)>c(HC2O4﹣)>c(H+)>c(C2O42﹣)>c(OH﹣),故答案为:c(Na+)>c(HC2O4﹣)>c(H+)>c(C2O42﹣)>c(OH﹣);(4)混合溶液中c(Na2CO3)=1×10﹣4mol/L,根据溶度积常数得混合溶液中c(CaCl2)=
+2×(﹣44.0kJ/mol)=﹣442.8 kJ∕mol,故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=﹣442.8 kJ∕mol; (3)二者恰好反应生成草酸氢钠,草酸氢钠溶液呈酸性c(H+)>c(OH﹣),则草酸氢根离子电离和水电离都生成氢离子,草酸氢根离子水解和电离程度较小,所以离子浓度大小顺序是c(Na+)>c(HC2O4﹣)>c(H+)>c(C2O42﹣)>c(OH﹣),故答案为:c(Na+)>c(HC2O4﹣)>c(H+)>c(C2O42﹣)>c(OH﹣);(4)混合溶液中c(Na2CO3)=1×10﹣4mol/L,根据溶度积常数得混合溶液中c(CaCl2)= ![]() =2.8×10﹣5mol/L,二者等体积混合时溶质浓度降为原来的一半,所以原来氯化钙浓度为5.6×10﹣5mol/L,故答案为:5.6×10﹣5;(5)该燃料电池中,负极上二甲醚失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OCH3﹣12e﹣+3H2O=3CO2+12H+ , 故答案为:CH3OCH3﹣12e﹣+3H2O=3CO2+12H+ .
=2.8×10﹣5mol/L,二者等体积混合时溶质浓度降为原来的一半,所以原来氯化钙浓度为5.6×10﹣5mol/L,故答案为:5.6×10﹣5;(5)该燃料电池中,负极上二甲醚失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OCH3﹣12e﹣+3H2O=3CO2+12H+ , 故答案为:CH3OCH3﹣12e﹣+3H2O=3CO2+12H+ .
(1)①化学平衡常数K= ![]() ;②若平衡时,CO的转化率大于水蒸气,则
;②若平衡时,CO的转化率大于水蒸气,则 ![]() ; ③根据浓度商与化学平衡常数相对大小判断反应方向,从而确定正逆反应速率相对大小;(2)根据盖斯定律书写;(3)草酸氢钠(NaHC2O4)溶液显酸性,说明草酸氢根离子电离程度大于水解程度,但水解和电离程度都较小;(4)c(CaCl2)=
; ③根据浓度商与化学平衡常数相对大小判断反应方向,从而确定正逆反应速率相对大小;(2)根据盖斯定律书写;(3)草酸氢钠(NaHC2O4)溶液显酸性,说明草酸氢根离子电离程度大于水解程度,但水解和电离程度都较小;(4)c(CaCl2)= ![]() ;(5)该燃料电池中,负极上燃料失电子发生氧化反应.
;(5)该燃料电池中,负极上燃料失电子发生氧化反应.

 阅读快车系列答案
阅读快车系列答案【题目】半导体生产中常需要控制掺杂,以保证控制电阻率.三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3 , 装置如图所示:(部分夹持装置略去)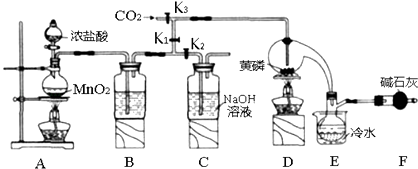
已知黄磷与少量Cl2反应生成PCl3 , 与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生 成 H3PO3和HC1.遇O2会生成P0Cl3 , P0Cl3溶于PCl3 , PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | ﹣112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 .
(2)B中所装试剂是 , E中冷水的作用是F中碱石灰的作用是
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2 , 再迅速加入黄磷.通干燥CO2的作用是 .
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后.通过(填实验操作名称),即可得到较纯净的PCl3 .
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL0.1000molL﹣1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000molL﹣1的Na2S2O3 , 溶液滴定
③重复②、③操作,平均消耗Na2S2O3 , 溶液8.40ml
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6 , 假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为 .