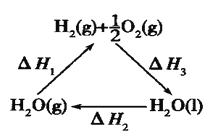
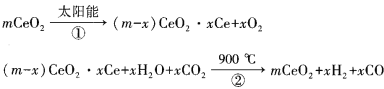题目内容
【题目】用序号填写下列空格:
(1)下列各组物质
①O2和O3 ②H2、D2和T2 ③12C和14 C ④石墨和足球烯(C60)
⑤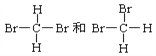 ⑥
⑥
⑦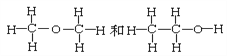 ⑧CH3CH3和CH3CH2CH2CH3
⑧CH3CH3和CH3CH2CH2CH3
互为同素异形体的是_____________;互为同位素的是______________,互为同分异构体的是______________,互为同系物的是_______________,同一种物质的是______________。
(2)现有① 金刚石 ② 干冰 ③ Na2SO4 ④ NH4Cl 四种物质,按下列要求回答:
晶体熔化时需要破坏共价键的是____________;熔点最低的是__________________;
晶体中只存在一种微粒间作用力是______________;属于离子晶体的是_____________。
请写出④ NH4Cl的电子式___________________
试判断 ①金刚石②干冰 ③Na2SO4晶体的熔点由高到低排列的顺序_________________。
【答案】 1,4 3 5,7 8 6 1 2 1 3,4 【答题空10】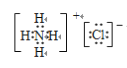 1>3>2
1>3>2
【解析】(1)本题考查“四同”,同素异形体是同种元素组成,结构不同的单质,因此属于同素异形体的是①④;同位素:质子数相同,中子数不同同一元素不同核素,属于同位素的是③;同分异构体:分子式相同,结构不同的化合物,属于同分异构体的是⑤⑦;同系物:结构相似,组成上相差一个或若干个“CH2”,因此属于同系物的是⑧;属于同一种物质的是⑥;(2)本题考查晶体类型的判断、化学键与物质的类别、电子式等,①为原子晶体,②干冰属于分子晶体,③属于离子晶体,④属于离子晶体,晶体熔化时需要破坏共价键,此晶体是原子晶体,即①正确;熔点高低一般是原子晶体>离子晶体>分子晶体,因此熔点最低的是分子晶体,即②正确;①只含共价键,②存在分子间作用力和共价键,③存在离子键和共价键,④存在离子键和共价键,因此只有一种作用力的是①;属于离子晶体的是③④;NH4Cl的电子式为: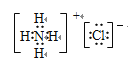 ;熔点高低一般是原子晶体>离子晶体>分子晶体,因此顺序是①>③>②。
;熔点高低一般是原子晶体>离子晶体>分子晶体,因此顺序是①>③>②。

【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答
(5)②和③按原子数1:2形成的化合物的电子式为____________,该晶体气化的过程中克
服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
【题目】近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:
(l)汽车发动机工作时会引起反应:N2(g)+O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。
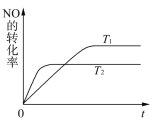
① 反应2NO(g)![]() N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
②一定温度下,能够说明反应2NO(g)![]() N2(g)+O2(g)已达到平衡的是_____(填序号);
N2(g)+O2(g)已达到平衡的是_____(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c. 2NO、N2、O2的浓度保持不变
d.单位时间内分解4molNO,同时生成2molN2
③ 在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mol)如下表所示。相同条件下达到平衡后,N2的体积分数最大的是_______(填容器代号);
容器代号 | NO | N2 | O2 |
A | 2 | 0 | 0 |
B | 0 | l | l |
C | 0.4 | 0.6 | 0.8 |
D | l | 0.5 | 0.4 |
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ·mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:___________;
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为___________________。