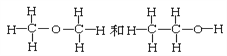
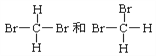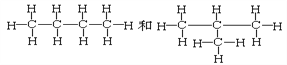题目内容
【题目】对下图中两极加以必要的联接并填空:
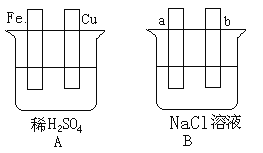
(1)在A图中,请加以必要联接,使铜片上冒H2气泡。________
Fe片的电极反应式:________________,溶液中SO42-向____(填“铁”或“铜”)片迁移。
(2)在B图中,请加以必要联接,使b极析出Cl2。总反应方程式:___________________。
(3)若将A、B串联(a接Cu,b接Fe),则a极析出的物质是____________。若导线中有0.2mol的电子通过, 则Fe片质量减少________, 同时a电极产生的气体在标准状况下的体积为__________ 。
【答案】 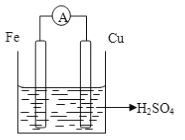
 Fe-2e-=Fe2+ 铁 2NaCl+2H2O
Fe-2e-=Fe2+ 铁 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ Cl2 5.6g 2.24L
2NaOH+H2↑+Cl2↑ Cl2 5.6g 2.24L
【解析】考查原电池的工作原理和电解原理,(1)使铜片上产生氢气,此装置可以是原电池,也可能是电解池,如果是原电池,该装置是 ,因为铁比铜活泼,且铁与硫酸反应,铜不与硫酸反应,因此铁作负极,铜作正极,负极电极反应式为Fe-2e-=Fe2+,正极电极反应式为2H++2e-=H2↑,根据原电池的工作原理,阴离子向负极移动,即SO42-向铁极移动;如果是电解池,因为铜棒上产生氢气,因此铜棒作阴极,铁棒作阳极,因此装置图是
,因为铁比铜活泼,且铁与硫酸反应,铜不与硫酸反应,因此铁作负极,铜作正极,负极电极反应式为Fe-2e-=Fe2+,正极电极反应式为2H++2e-=H2↑,根据原电池的工作原理,阴离子向负极移动,即SO42-向铁极移动;如果是电解池,因为铜棒上产生氢气,因此铜棒作阴极,铁棒作阳极,因此装置图是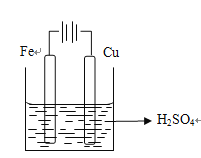 ,根据电解原理,铁是活动性金属,先放电,阳极反应式为Fe-2e-=Fe2+,阴离子向阳极移动,即移向铁极;(2)B装置是电解饱和食盐水,属于电解装置,应为b极上产生氯气,因此b极作阳极,a极作阴极,因此电解装置图为
,根据电解原理,铁是活动性金属,先放电,阳极反应式为Fe-2e-=Fe2+,阴离子向阳极移动,即移向铁极;(2)B装置是电解饱和食盐水,属于电解装置,应为b极上产生氯气,因此b极作阳极,a极作阴极,因此电解装置图为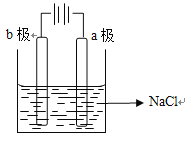 ,电解饱和食盐水,总反应方程式为2NaCl+2H2O
,电解饱和食盐水,总反应方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;(3)若将A、B串联,A为原电池,B为电解池,铜接a,a为阳极,则b为阴极,阳极反应式为2Cl--2e-=Cl2↑,析出的物质是Cl2;铁片上电极反应式为Fe-2e-=Fe2+,转移0.2mol电子,消耗铁的物质的量为0.1mol,即质量减少0.1×56g=5.6g,a极上产生氯气的体积为0.1×22.4L=2.24L。
2NaOH+H2↑+Cl2↑;(3)若将A、B串联,A为原电池,B为电解池,铜接a,a为阳极,则b为阴极,阳极反应式为2Cl--2e-=Cl2↑,析出的物质是Cl2;铁片上电极反应式为Fe-2e-=Fe2+,转移0.2mol电子,消耗铁的物质的量为0.1mol,即质量减少0.1×56g=5.6g,a极上产生氯气的体积为0.1×22.4L=2.24L。