题目内容
1.欲使1L 0.5mol/L的NaOH溶液的浓度增大一倍,可采取的合理措施是( )| A. | 加入20g 固体NaOH,搅拌、溶解 | |
| B. | 将溶液加热浓缩至0.6 L | |
| C. | 加入10mol/L的NaOH溶液0.1 L,再稀释至1.5 L | |
| D. | 加入1 L 1.5 mol/L的NaOH溶液混合均匀 |
分析 1L 0.5mol/L的NaOH溶液的浓度增大一倍,即改变后的溶液的浓度是1mol/L,
A.20g氢氧化钠的物质的量为0.5mol,向1L溶液中进入0.5mol氢氧化钠固体,溶液的体积会发生变化,所以溶液浓度不等于1mol/L;
B.将溶液加热浓缩至0.6L,溶液的浓度变为原先的:$\frac{1L}{0.6L}$=$\frac{5}{3}$倍;
C.先计算出氢氧化钠的总物质的量,然后根据c=$\frac{n}{V}$计算出所得溶液的浓度;
D.两溶液混合后溶液的体积会发生变化,混合液体积不等于2L.
解答 解:1L 0.5mol/L的NaOH溶液的浓度增大一倍,即改变后的溶液的浓度是1mol/L,
A.加入20g固体NaOH,搅拌、溶解,由于溶解后的溶液体积会发生变化,氢氧化钠的物质的量为1mol,但是溶液的体积不是1L,所以浓度不是1mol/L,故A错误;
B.将溶液加热浓缩至0.6L,溶液的浓度变为原先的:$\frac{1L}{0.6L}$=$\frac{5}{3}$倍,浓缩后溶液的浓度为:0.5mol/L×$\frac{5}{3}$=$\frac{2.5}{3}$mol/L,故B错误;
C.加入10mol/L的NaOH溶液0.1L,再稀释至1.5L,此时溶液中氢氧化钠的浓度为:c(NaOH)=$\frac{0.5mol/L×1L+10mol/L×0.1L}{1.5L}$=1mol/L,浓度变为原先的2倍,故C正确;
D.加入1 L 1.5 mol/L的NaOH溶液即加入了1.5mol的NaOH,溶液中NaOH的总物质的量是2mol,但溶液的体积不是2L,所以溶液的浓度不是1mol/L,故D错误;
故选C.
点评 本题考查物质的量浓度的计算,题目难度中等,熟练掌握物质的量浓度的概念及表达式为解答关键,注意明确溶液稀释过程中溶质的物质的量不变,试题培养了学生的分析能力及化学计算能力.

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 1 mol 任何物质所含的分子数均为NA个 | |
| B. | 14 g氮气所含的N原子数为NA个 | |
| C. | 标准状况下,22.4 L水所含的H2O分子数为NA个 | |
| D. | 在钠与氯气的反应中,1 mol钠失去电子的数目为2 NA个 |
| A. | 用量筒量取一定体积液体时,俯视读出的读数 | |
| B. | 用标准盐酸滴定未知浓度的NaOH溶液,酸式滴定管未用标准盐酸润洗,所测出的碱液的浓度值 | |
| C. | 同一滴定实验,一般要做三次,取三次实验的平均值进行计算,但某同学只做了一次 | |
| D. | 达到滴定终点时,俯视读数 |
| A. | C(Ba2+)•C(SO42-)≠Ksp C(Ba2+)<C(SO42-) | |
| B. | C(Ba2+)•C(SO42-)>Ksp C(Ba2+)=C(SO42-) | |
| C. | C(Ba2+)=C(SO42-)=Ksp½ | |
| D. | C(Ba2+)•C(SO42-)=Ksp C(Ba2+)>C(SO42-) |
| A. | 法国化学家维勒首次提出有机化学的概念;德国化学家贝采里乌斯由氰酸铵合成了尿素,首次打破了有机物和无机物的界限 | |
| B. | 李比希用燃烧法来测定有机化合物中碳氢元素质量分数 | |
| C. | 用核磁共振氢谱和红外光谱法可以区别乙醇和二甲醚(CH3OCH3) | |
| D. | 用“同位素示踪法”是研究有机化学反应历程的手段之一 |
| A. | 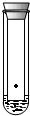 装置可用于叶绿体中色素的分离 | |
| B. | 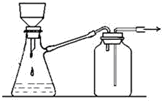 装置可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀 | |
| C. | 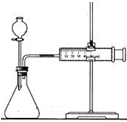 装置可用于某些化学反应速率的测定.该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处 | |
| D. |  装置不可用来模拟氯碱工业 |
| A. | 离子化合物中可能含共价键,共价化合物中不含离子键 | |
| B. | 共价化合物中可能含离子键,离子化合物中只含离子键 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 双原子分子中的共价键,一定是非极性键 |
| A. | 1mol H2约含有6.02×1023个微粒 | |
| B. | 水的摩尔质量是18g | |
| C. | 氯化氢的摩尔质量就是它的相对分子质量 | |
| D. | 相同物质的量的SO2和SO3,含氧原子个数之比为2:3 |
 NH3•H2O+H+.
NH3•H2O+H+. 2NH3(g)△H=-2a kJ mol-1.
2NH3(g)△H=-2a kJ mol-1.