题目内容
16.A、B、C、D四种短周期元素,原子序数依次增大;A和C能形成一种分子X或一种+1价阳离子Y;B元素的原子有两个未成对电子;C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体.试回答下列问题:(1)A、D元素的名称分别为:A氢 D氧.
(2)X与等物质的量的HCl反应,产物溶于水得酸性(填“酸性”、“中性”或“碱性”)溶液,用离子方程式表示其原因NH4++H2O
 NH3•H2O+H+.
NH3•H2O+H+.(3)12gB单质在空气中完全燃烧,将燃烧后的气体缓慢通入1L1mol•L-1的NaOH溶液中,充分吸收后,最终所得溶液中各离子浓度由大到小的顺序是:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(4)把1molC的单质、3molA的单质置于一恒温恒容密闭容器中反应,达到平衡时,放出akJ的热量,此时,容器内的压强是反应开始时的75%,写出该反应的热化学方程式N2(g)+3H2(g)
 2NH3(g)△H=-2a kJ mol-1.
2NH3(g)△H=-2a kJ mol-1.
分析 A、B、C、D四种短周期元素,原子序数依次增大,C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,则C为N元素、D为O元素;B元素的原子有两个未成对电子,原子序数小于氮,核外电子排布为1s22s22p2,故B为碳元素;A和C能形成一种分子X或一种+1价阳离子Y,A为H元素,X为NH3,Y为NH4+,据此解答.
解答 解:A、B、C、D四种短周期元素,原子序数依次增大,C、D在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,则C为N元素、D为O元素;B元素的原子有两个未成对电子,原子序数小于氮,核外电子排布为1s22s22p2,故B为碳元素;A和C能形成一种分子X或一种+1价阳离子Y,A为H元素,X为NH3,Y为NH4+.
(1)由上述分析可知,A为氢元素,D为氧元素,故答案为:氢;氧;
(2)X为NH3,与等物质的量的HCl反应生成NH4Cl,溶液中NH4+水解:NH4++H2O
故答案为:酸性;NH4++H2O
(3)12g碳单质的物质的量为$\frac{12g}{12g/mol}$=1mol,所以生成的二氧化碳为1mol,氢氧化钠的物质的量为l L×l mol/L=1mol,n(CO2):n(NaOH)=1:1,所以二氧化碳与氢氧化钠反应生成NaHCO3,HCO3-的水解沉淀等于电离程度,溶液呈碱性,溶液中氢离子源于水的电离、碳酸氢根电离,故溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(4)N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3 物质的量减小
1 2
n (1mol+3mol)×(1-75%)=1mol
故n=0.5mol,则1mol氮气反应放出的热量为2a kJ,反应热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-2a kJ mol-1,
2NH3(g)△H=-2a kJ mol-1,
故答案为:N2(g)+3H2(g) 2NH3(g)△H=-2a kJ mol-1.
2NH3(g)△H=-2a kJ mol-1.
点评 本题考查结构性质与位置关系综合应用,涉及盐类水解应用、热化学方程式、化学平衡计算等,难度中等,是对所学知识的综合考查,推断元素是解题的关键.

| A. | 2Al(s)+2NaOH(aq)+2H2O(1)═2NaAlO2(aq)+3H2(g);△H<O | |
| B. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3•H2O(aq)+8H2O(1);△H>0 | |
| C. | C3H8(g)+5O2(g)→4H2O (l)+3CO2(g);△H<0 | |
| D. | FeCl3(aq)十3H2O(1)?Fe(OH)3(s)+3HCl(aq);△H>0 |
| A. | 制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞 | |
| B. | 在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷气体的纯度 | |
| C. | 实验时将所有的废气通过通风橱排出实验室,以免污染实验室 | |
| D. | 给试管中的液体加热时不时移动试管或加入碎瓷片,以免暴沸伤人 |
| A. | 浓硝酸加热能放出氧气 | |
| B. | 浓HNO3跟浓盐酸可配制成王水 | |
| C. | HNO3跟金属反应可生成价态不同的氧化物 | |
| D. | 浓HNO3跟铜剧烈反应且不需加热 |
| A. | 某离子结构示意图为: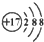 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式为: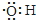 ,可以表示羟基,也可以表示氢氧根离子 ,可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型为: ,可以表示甲烷分子,也可以表示四氯化碳分子 ,可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 晶体锗的结构为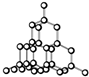 ,其晶胞可表示为 ,其晶胞可表示为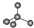 |
| A. | 加入20g 固体NaOH,搅拌、溶解 | |
| B. | 将溶液加热浓缩至0.6 L | |
| C. | 加入10mol/L的NaOH溶液0.1 L,再稀释至1.5 L | |
| D. | 加入1 L 1.5 mol/L的NaOH溶液混合均匀 |
| A. | CH3-CH=CH2与HCl加成 | |
| B. | C6H5-CH3在铁粉存在下与氯气反应 | |
| C. | CH3-CH2-CHBr-CH3在氢氧化钠乙醇溶液中加热反应 | |
| D. | CH3-CHOH-CH3在浓硫酸存在下,发生分子内脱水 |
| A. | 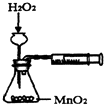 测定反应速率 | B. | 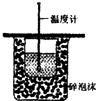 测定中和热 | ||
| C. | 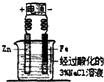 牺牲阳极的阴极保护法 | D. |  铁的吸氧腐蚀实验 |
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 2%的GA溶液能破坏菌体蛋白质,杀死微生物 |