题目内容
9.在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积,则平衡后溶液中( )| A. | C(Ba2+)•C(SO42-)≠Ksp C(Ba2+)<C(SO42-) | |
| B. | C(Ba2+)•C(SO42-)>Ksp C(Ba2+)=C(SO42-) | |
| C. | C(Ba2+)=C(SO42-)=Ksp½ | |
| D. | C(Ba2+)•C(SO42-)=Ksp C(Ba2+)>C(SO42-) |
分析 在BaSO4饱和溶液中存在沉淀溶解平衡:BaSO4(s)?Ba2++SO42-,加入氯化钡溶液c(Ba2+)增大,沉淀溶解平衡向生成沉淀的方向进行,因Ksp不变,则c(SO42-)浓度减小,以此解答该题.
解答 解:因温度不变,则Ksp不变,加入氯化钡溶液c(Ba2+)增大,沉淀溶解平衡向生成沉淀的方向进行,因Ksp=c(Ba2+)•c(SO42-)不变,则c(SO42-)浓度减小,且c(Ba2+)>c(SO42-),故选D.
点评 本题考查难溶电解质的溶解平衡移动,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意把握溶度积常数的影响因素及溶度积常数的应用、沉淀的转化原理.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
19.在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:
2A(?)+B(?)?xC(g)△H<0
平衡时M中A、B、C的物质的量之比为1:3:2.下列判断正确的是( )
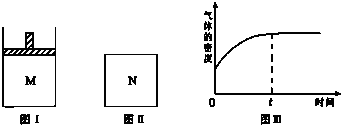
2A(?)+B(?)?xC(g)△H<0
平衡时M中A、B、C的物质的量之比为1:3:2.下列判断正确的是( )

| A. | x=4 | |
| B. | 若N中气体的密度如图Ⅲ所示,则A、B都是气态 | |
| C. | 若A为气体,B为非气体,则平衡时M、N中C的物质的量相等 | |
| D. | 若A、B均为气体,平衡时M中A的转化率大于N中A的转化率 |
17.将4体积的H2和1体积的O2混合,4g这种混合气体在标准状况下所占的体积是( )
| A. | 5.6 L | B. | 11.2 L | C. | 22.4 L | D. | 33.6 L |
4.证明浓HNO3的氧化性比浓H2SO4的氧化性强的事实是( )
| A. | 浓硝酸加热能放出氧气 | |
| B. | 浓HNO3跟浓盐酸可配制成王水 | |
| C. | HNO3跟金属反应可生成价态不同的氧化物 | |
| D. | 浓HNO3跟铜剧烈反应且不需加热 |
14.下列说法错误的是( )
| A. | 氨是极性分子,其在水中的溶解度很大 | |
| B. | DNA中的碱基互补配对是通过氢键来实现的 | |
| C. | 气体单质中,一定有σ键,可能有π键 | |
| D. | 元素“氦、铷、铯”等是用光谱分析方法发现的 |
1.欲使1L 0.5mol/L的NaOH溶液的浓度增大一倍,可采取的合理措施是( )
| A. | 加入20g 固体NaOH,搅拌、溶解 | |
| B. | 将溶液加热浓缩至0.6 L | |
| C. | 加入10mol/L的NaOH溶液0.1 L,再稀释至1.5 L | |
| D. | 加入1 L 1.5 mol/L的NaOH溶液混合均匀 |
18.利用下列有关实验装置进行相应的实验,能达到实验目的是( )
| A. | 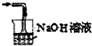 用装置吸收二氧化硫气体 | |
| B. |  用装置除去氯气中的氯化氢杂质 | |
| C. |  用装置可以对硫化氢气体进行尾气处理 | |
| D. |  用装置制备并收集氧气 |
19.以下实验不能获得成功的是( )
| A. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| B. | 提取溶解在水中的少量碘时加入CCl4,分液,取出有机层再分离 | |
| C. | 用适量苯和液溴混合制溴苯时,只需加铁屑,不必加热 | |
| D. | 除去溴苯中的少量Br2时加入KI溶液,充分反应后,弃去水溶液 |