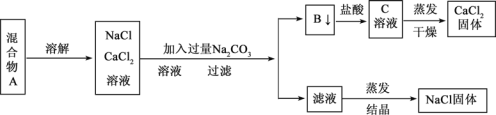
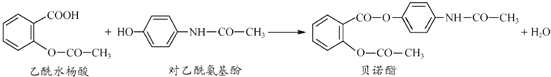
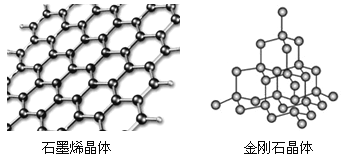
题目内容
【题目】用适量MnO2和10mol/L的盐酸100mL(过量)反应制取Cl2,若反应过程中有0.2mol电子发生转移,求:
(1)生成标准状况下Cl2的体积是多少?
(2)被氧化的HCl占原有HCl的物质的量百分数是多少?
【答案】(1)2.24L (2)20%
【解析】(1)MnO2与浓盐酸反应制取Cl2的化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,因为Cl的化合价由-1→0,所以每转移2mol电子,生成1mol氯气,因此有0.2mol电子发生转移时,生成0.1mol氯气,在标准状况下,0.1mol氯气的体积为:V=nVm=0.1mol×22.4L/mol=2.24L。
MnCl2+Cl2↑+2H2O,因为Cl的化合价由-1→0,所以每转移2mol电子,生成1mol氯气,因此有0.2mol电子发生转移时,生成0.1mol氯气,在标准状况下,0.1mol氯气的体积为:V=nVm=0.1mol×22.4L/mol=2.24L。
(2)由化学方程式及前面的分析可得,0.2mol电子发生转移时,被氧化的HCl为0.2mol,原有HCl的物质的量是为10mol/L×0.1L=1mol,所以被氧化的HCl占原有HCl的物质的量百分数是:0.2mol×1mol×100%=20%。

练习册系列答案
相关题目