题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1.8 g H218O与D2O的混合物中所含中子数为NA
B. 16.9g过氧化钡(BaO2)固体中阴、阳离子总数为0.3NA
C. 标准状况下的33.6 mL氯气通入足量水中,转移电子数为1.5×10-3 NA
D. 在5 NH4NO3 ![]() 2 HNO3+4 N2↑+9 H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2 HNO3+4 N2↑+9 H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
【答案】D
【解析】
A. H218O与D2O每个分子都含有10个中子,摩尔质量都为20g/mol,1.8gH218O与D2O的混合物物质的量小于0.1mol,含有中子数为小于NA,故A错误;
B. 16.9g过氧化钡的物质的量为0.1mol,而1mol过氧化钡中含1mol钡离子和1mol过氧根,故0.1mol过氧化钡中含0.2mol离子即0.2NA个,故B错误;
C. 33.6mL氯气的物质的量为1.5×10-3mol,反应Cl2+H2O![]() HCl+HClO为可逆反应,不可能进行完全,反应中氯气起氧化剂与还原剂作用,各占一半,故转移电子数小于1.5×10-3NA,故C错误;
HCl+HClO为可逆反应,不可能进行完全,反应中氯气起氧化剂与还原剂作用,各占一半,故转移电子数小于1.5×10-3NA,故C错误;
D. 在5NH4NO3 ![]() 2HNO3+4N2↑+9H2O反应中,其中5个-3价的N,变成N2,化合价升高15,有3个+5价的N,化合价降低15,生成4 N2,所以生成28 g N2时,转移的电子数目为
2HNO3+4N2↑+9H2O反应中,其中5个-3价的N,变成N2,化合价升高15,有3个+5价的N,化合价降低15,生成4 N2,所以生成28 g N2时,转移的电子数目为![]() ×NA=3.75NA,故D正确。
×NA=3.75NA,故D正确。
故答案选D。

【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是( )
,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是( )
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol,则该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() =
=![]() ,则此时的温度为1 000 ℃
,则此时的温度为1 000 ℃
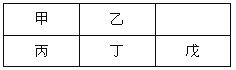
【题目】如表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为______________________。
(2)表中元素原子半径最大的是(写元素符号)_____________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为_________。Q与水反应的化学方程式为____。
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2molL-1NaOH溶液和1mol O2,则两种气体的分子式及物质的量分别为____________。生成硫酸铜物质的量为_____________。
【题目】某温度T1时,向容积为2L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g) ![]() 2HI(g),反应过程中测定的部分数据见下表(表中t2>t1)。下列说法正确的是
2HI(g),反应过程中测定的部分数据见下表(表中t2>t1)。下列说法正确的是
反应时间/min | n(H2)/mol | n(I2)/mol |
0 | 0.9 | 0.3 |
t1 | 0.8 | |
t2 | 0.2 |
A. 反应在tmin内的平均速率为:v(H2)=![]() mol-1·L-1·min-l
mol-1·L-1·min-l
B. 保持其他条件不变,向平衡体系中再通0.20molH2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变
C. 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时 n(HI)=0.2mol
D. 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应