题目内容
【题目】根据物质结构和元素周期表的相关知识回答下列问题:
I.用A+、B-、C2-、D表示含有18个电子的离子或分子。请填空:
(1)A元素是__________,B元素是__________,C元素是__________。(用元素符号表示)
(2)物质D由两种元素组成,每个分子中含有三个原子,其分子式是________,电子式是______________。
Ⅱ.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
回答下列问题:
(1)Y在元素周期表中的位置为______________,
(2)上述元素的最高价氧化物对应的水化物酸性最强的是______________ (写化学式),非金属气态氢化物还原性最强的是______________(写化学式)。
(3)Y和Z的两元素之间形成的原子个数比为1:1的化合物的电子式为______________。
【答案】K Cl S H2S ![]() 第二周期第ⅥA族 HClO4 H2S
第二周期第ⅥA族 HClO4 H2S ![]()
【解析】
I.18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等;
Ⅱ.X、Y、Z、M、G五种元素分属三个不同短周期,且原子序数依次增大,所以X为第一周期元素,为氢元素,Y、M同主族,可形成MY2、MY3两种分子,则Y为氧元素,M为硫元素,G为氯元素,X、Z同主族,可形成离子化合物ZX,则Z为钠元素,据此答题。
(1)A+的核内质子数=核外电子数+电荷数=18+1,则该元素是K元素;B-的核内质子数=核外电子数-电荷数=18-1=17,则该元素是Cl元素;C2-的核内质子数=核外电子数-电荷数=18-2=16;
答案:K Cl S
(2)物质D由两种元素组成,每个分子中含有三个原子,应该是第三周期元素的气态氢化物,确定为硫化氢;
答案: H2S ![]()
Ⅱ.由上面分析可知:X为H、Y为O、Z为Na、M为S、G为Cl;
(1)Y为氧元素,在元素周期表中的位置为第二周期第ⅥA族;
答案:第二周期第ⅥA族
(2)非金属性越强,最高价氧化物水化物酸性越强;非金属性越弱,气态氢化物还原性越强;非金属性比较:O>Cl>S;
答案:HClO4 H2S
(3)Y和Z的两元素之间形成的原子个数比为1:1的化合物是Na2O2,电子式为![]() ;
;
答案:![]()

 名校课堂系列答案
名校课堂系列答案【题目】化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
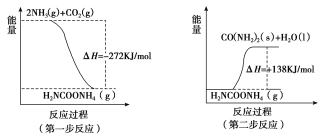
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为___________________________。
(2)已知反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
温度(℃) | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
①该反应的化学平衡常数K的表达式为____________,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v(CO)为_______________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动, 可采取的措施有 ___________。
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式_____________________,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=_________(溶液电解前后体积的变化忽略不计)。