题目内容
2.物质的量在计算中有广泛的应用,请完成下列各小题:(1)9g H2O与49g H3PO4所含分子数相等;
(2)固体X在一定条件下加热分解,其方程式为2X$\frac{\underline{\;\;△\;\;}}{\;}$Y↑+2Z↑+2W↑,测得生成的混合气体的密度是相同状况下H2的a倍,则X的相对分子质量为5a;
(3)在同温同压下,6.5g某气体A的分子数与7g C2H4的分子数相同,则气体A在标准状况下的密度为1.16g•L-1(结果保留三位有效数字);
(4)b%的硫酸溶液与4b%的硫酸溶液等质量混合后,所得溶液的质量分数=(填“>”“<”或“=”,下同)2.5b%;如果等体积混合,所得溶液的质量分数>2.5b%.
分析 (1)分子数相同,则物质的量相同,结合n=$\frac{m}{M}$计算;
(2)相同条件下,气体的密度之比等于其摩尔质量之比,生成的混合气体对氢气的相对密度为a,则混合气体的平均摩尔质量为2ag/mol,根据质量守恒再结合M=$\frac{m}{n}$计算X的摩尔质量,摩尔质量在数值上等于其相对分子质量;
(3)分子数相同,则物质的量相同,结合n=$\frac{m}{M}$、ρ=$\frac{M}{Vm}$计算;
(4)等质量混合,混合后浓度等于$\frac{m×b%+m×4b%}{2m}$;硫酸的浓度越大,密度越大,硫酸的密度大于水的密度,将两个质量分数的硫酸等体积混合,则混合后的质量分数比原来两硫酸的质量分数的平均值要大,对于密度小于水的溶液,将两个质量分数的溶液等体积混合,则混合后的质量分数比原来两溶液的质量分数的平均值要小.
解答 解:(1)水的物质的量为$\frac{9g}{18g/mol}$=0.5mol,分子数相同,则物质的量相同,可知H3PO4的质量为0.5mol×98g/mol=49g,故答案为:49;
(2)相同条件下,气体的密度之比等于其摩尔质量之比,生成的混合气体对氢气的相对密度为a,则混合气体的平均摩尔质量为2a/mol,假设有2molX反应则生成1molY、2molZ、2molW,生成物的质量=2ag/mol×(1+2+2)mol=10ag,反应前后质量不变,则X的质量为10ag,其摩尔质量=$\frac{10ag}{2mol}$=5ag/mol,摩尔质量在数值上等于其相对分子质量,所以X的相对分子质量为5a,故答案为:5a;
(3)同温同压下,6.5g某气体A的分子数与7g C2H4的分子数相同,A的物质的量为$\frac{7g}{28g/mol}$=0.25mol,M(A)=$\frac{6.5g}{0.25mol}$=26g/mol,则气体A在标准状况下的密度为$\frac{26g/mol}{22.4L/mol}$=1.16g/L,故答案为:1.16;
(4)b%的硫酸溶液与4b%的硫酸溶液等质量混合后,所得溶液的质量分数等于$\frac{m×b%+m×4b%}{2m}$=2.5b%;硫酸的密度大于水,将两个质量分数的硫酸等体积混合,则混合后的质量分数比原来两硫酸的质量分数的平均值要大,即将b%的硫酸溶液与4b%的硫酸溶液等体积混合,所得硫酸溶液的质量分数要大于2.5b%,
故答案为:=;>.
点评 本题考查物质的量及浓度的计算,为高频考点,把握物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

| A. | 稀硫酸中加入铜粉:Cu+2H+═Cu2++H2↑ | |
| B. | 用FeCl3溶液刻蚀铜制印刷电路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO32-+H2O | |
| D. | 硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
| A. | CH3CH=C(CH3)CH2CH3 | B. | (CH3)2C=CHCH2CH3 | ||
| C. | CH3CH=CHCH(CH3)2 | D. | CH2=CHCH2CH(CH3)2 |
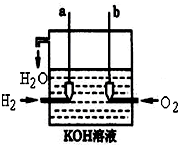 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.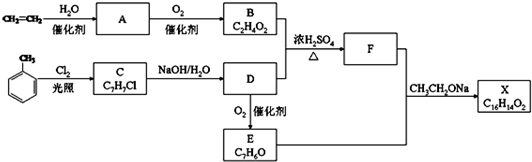
 ;
; ;
; CH2CH2OOCH、
CH2CH2OOCH、 COOCH2CH3、
COOCH2CH3、 CH2COOCH3、
CH2COOCH3、 00CCH2CH3.
00CCH2CH3.