题目内容
【题目】碲(Te)为第VIA元素,其单质凭借优良的性能成为制作合金添加剂、半导体、光电元件的主体材料,并被广泛应用于冶金、航空航天、电子等领域。可从精炼铜的阳极泥(主要成分为Cu2Te)中回收碲,
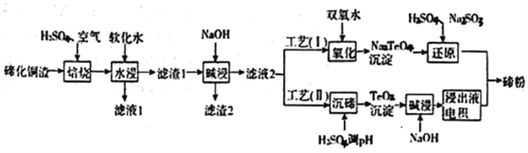
(1)“培烧”后,确主要以TeO2形式存在,写出相应反应的离子方程式:________________________。
(2)为了选择最佳的培烧工艺进行了温度和硫酸加入量的条件试验,结果如下表所示:
温度/℃ | 硫酸加入量(理论量倍数) | 浸出率/% | |
Cu | Te | ||
450 | 1.25 | 77.3 | 2.63 |
460 | 1.00 | 80.29 | 2.81 |
1.25 | 89.86 | 2.87 | |
1.50 | 92.31 | 7.70 | |
500 | 1.25 | 59.83 | 5.48 |
550 | 1.25 | 11.65 | 10.63 |
则实验中应选择的条件为_________________,原因为______________________________。
(3)滤渣1在碱浸时发生的化学方程式为_____________________________。
(4)工艺(I)中,“还原”时发生的总的化学方程式为____________________________。
(5)由于工艺(I)中“氧化”对溶液和物料条件要求高。有研究者采用工艺(II)获得磅.则“电积”过程中,阴极的电极反应式为____________________________________。
(6)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3与滤液1合井。进入铜电积系统。该处理措施的优点为_____________________________。
②滤渣3中若含Auspan>和Ag,可用_____将二者分离。(填字母)
A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.浓盐酸
【答案】 Cu2Te+4H++2O2![]() 2Cu2++TeO2+2H2O 460℃,硫酸用量为理论量的1.25倍 该条件下,铜的浸出率高且碲的损失较低 ToO2+2NaOH=Na2TeO3+H2O Na2TeO4+3Na2SO3+H2SO4==4Na2SO4+Te+H2O TeO32-+ 4e-+3H2O=Te+6OH- CuSO4溶液回收利用,提高经济效益 B
2Cu2++TeO2+2H2O 460℃,硫酸用量为理论量的1.25倍 该条件下,铜的浸出率高且碲的损失较低 ToO2+2NaOH=Na2TeO3+H2O Na2TeO4+3Na2SO3+H2SO4==4Na2SO4+Te+H2O TeO32-+ 4e-+3H2O=Te+6OH- CuSO4溶液回收利用,提高经济效益 B
【解析】(1)Cu2Te在H2SO4条件下,与氧气在高温下反应生成TeO2和CuSO4,反应的离子方程式Cu2Te+4H++2O2![]() 2Cu2++TeO2+2H2O;正确答案:Cu2Te+4H++2O2
2Cu2++TeO2+2H2O;正确答案:Cu2Te+4H++2O2![]() 2 Cu2++TeO2+2H2O 。
2 Cu2++TeO2+2H2O 。
(2)从图表信息可知:当硫酸的量一定时,温度升高时,铜的浸出率降低;温度一定时,铜和Te的浸出率均增大。在460℃条件下,硫酸用量为理论量的1.25倍的条件下最佳,铜的浸出率高且Te 的损失较小;正确答案:460℃,硫酸用量为理论量的1.25倍;该条件下,铜的浸出率高且碲的损失较低。
(3)从流程可知,滤渣1为ToO2,它可与碱反应生成TeO32-;正确答案: ToO2+2NaOH=Na2TeO3+H2O。
(4)从流程图可知:Na2TeO4被Na2SO3还原为Te,而Na2SO3被氧化为Na2SO4,总反应方程式:Na2TeO4+3Na2SO3+H2SO4==4Na2SO4+Te+H2O;正确答案:Na2TeO4+3Na2SO3+H2SO4=4Na2SO4 +Te+H2O。
(5)根据反应ToO2+2NaOH=Na2TeO3+H2O,生成的TeO32-在阴极得电子被还原为Te,极反应方程式为:TeO32-+4e-+3H2O=Te+6OH- ;正确答案:TeO32-+4e-+3H2O=Te+6OH-。
(6)①工业生产中,滤渣2为少量的氢氧化铜固体,经硫酸酸浸后得滤液硫酸铜,滤液1中主要成分也为硫酸铜,滤液3与滤液1合并进入铜电积系统,提取金属铜,有效回收利用了硫酸铜,提高经济效益;正确答案:CuSO4溶液回收利用,提高经济效益。
②Au和Ag都与王水反应,与浓氢氧化钠溶液、.浓盐酸均不反应;但是Au与稀硝酸不反应而Ag可以反应,所以可以用稀硝酸将二者分离;正确答案: B。