题目内容
3.(1)等物质的量的钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积之比是1:2:3.(2)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝的物质的量之比是6:3:2.
分析 发生反应:2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑.
(1)金属完全反应,令金属的物质的量为2mol,根据方程式计算生成氢气的物质的量,相同条件下,气体体积之比等于其物质的量之比;
(2)相同条件下生成氢气体积相同,则氢气物质的量相等,设氢气为3mol,根据方程式计算金属的物质的量.
解答 解:(1)金属完全反应,令金属的物质的量为2mol,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑
2mol 1mol 2mol 2mol 2mol 3mol
故相同条件下,生成氢气的体积之比为1mol:2mol:3mol=1:2:3;
故答案为:1:2:3;
(2)相同条件下生成氢气体积相同,则氢气物质的量相等,设氢气为3mol,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑
6mol 3mol 3mol 3mol 2mol 3mol
故所需钠、镁、铝的物质的量之比是6mol:3mol:2mol=6:3:2,
故答案为:6:3:2.
点评 本题考查化学方程式计算有关计算,比较基础,注意运用特殊值简化计算,也可以利用电子转移守恒计算.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
17.有三种化合物:①NaHCO3、②Al(OH)3、③H2NCH2COOH,跟盐酸和氢氧化钠溶液都能反应的是( )
| A. | 只有② | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
14.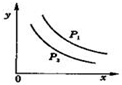 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中R的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中R的体积分数.据此可判断( )
 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中R的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中R的体积分数.据此可判断( )| A. | 上述正反应是放热反应 | B. | 上述正反应是吸热反应 | ||
| C. | 增大L的量,平衡正向移动 | D. | a<b |
11.水凝结成冰的过程的焓变和熵变正确的是( )
| A. | △H>0,△S<0 | B. | △H<0,△S>0 | C. | △H>0,△S>0 | D. | △H<0,△S<0 |
8.现有A、B、C、D四种金属片,
①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;
②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;
③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C.
根据上述情况判断四种金属的活泼由强到弱的顺序为( )
①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;
②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;
③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C.
根据上述情况判断四种金属的活泼由强到弱的顺序为( )
| A. | DCAB | B. | CBAD | C. | BADC | D. | BACD |
15.用1L 1.0mol•L-1NaOH溶液吸收0.8molSO2,所得溶液中的SO32-和HSO3-的物质的量浓度之比是( )
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
12.下列图示的装置可以构成原电池的是( )
| A. | 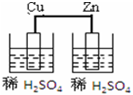 | B. | 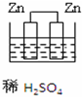 | C. | 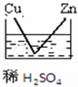 | D. | 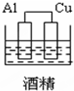 |
13.在标准状况下,将11.2L的HCl溶于水配成0.5L盐酸,则所得溶液的浓度是( )
| A. | 1mol•L-1 | B. | 0.5mol•L-1 | ||
| C. | 22.4mol•L-1 | D. | 缺少密度无法计算 |
 .
.