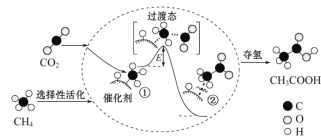
题目内容
【题目】生产钡盐的主要原料是重晶石(BaSO4)。在高温下,重晶石与石墨存在如下反应:
①: BaSO4(s)+4C(s,石墨) ![]() 4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
②: BaSO4(s)+4CO(g) ![]() 4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol
4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol
回答下列问题:
(1)反应①在一定条件下能够自发的原因:_______________;
(2)已知:C(s,石墨)+O2(g) = CO2(g) ΔH3 =-393.5 kJ/mol;
求 CO 的标准燃烧热ΔH4 = _______kJ/mol;
(3)图 1 为 1200K下, 恒容密闭容器中重晶石与石墨反应时, c(CO)随时间变化曲线图。 请分析图 1 曲线 c(CO)在 0-t2 区间变化的原因:_________________;
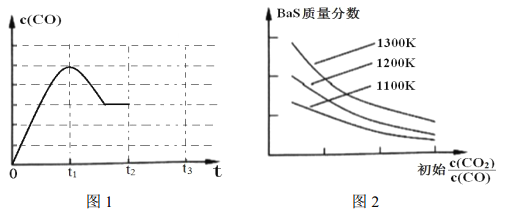
(4)图2为实验测得不同温度下, 反应体系中初始浓度比![]() 与固体中BaS质量分数的关系曲线。 分析图2 曲线, 下列说法正确的有________;
与固体中BaS质量分数的关系曲线。 分析图2 曲线, 下列说法正确的有________;
A.提高 BaSO4 的投料量,可提高 BaS 的产率
B.恒温恒容时, 当混合气体的密度不变, 反应①、②均达到化学平衡状态
C.减小初始浓度比![]() ,有利于增大 BaSO4 的转化率
,有利于增大 BaSO4 的转化率
D.适当升高温度,反应②的平衡左移,对生成 BaS不利
(5)图1 中, t2 时刻将容器体积减小为一半, t3 时刻达到新的平衡, 请在图 1 中画出 t2-t3 区间 c(CO)的变化曲线。________________
(6)工业生产中产生的 SO2 废气可用如图方法获得H2SO4。写出电解的阳极反应式_________。
【答案】 反应①ΔS>0,ΔH>0,在较高温度下能自发 -283 反应速率①比②大,故开始阶段c(CO)增大,后来反应②为主,故c(CO)减小 BC 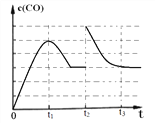 Mn2+-2e-+2H2O =MnO2↓+4H+
Mn2+-2e-+2H2O =MnO2↓+4H+
【解析】①: BaSO4(s)+4C(s,石墨) ![]() 4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol 为ΔH1>0,反应物均为固态,生成物有气态故反ΔS>0。所以反应①ΔS>0,ΔH>0,在较高温度下能自发。
4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol 为ΔH1>0,反应物均为固态,生成物有气态故反ΔS>0。所以反应①ΔS>0,ΔH>0,在较高温度下能自发。
②: BaSO4(s)+4CO(g) ![]() 4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol
4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol
(2)③C(s,石墨)+O2(g) = CO2(g) ΔH3 =-393.5 kJ/mol由上述反应方程式 ③- ![]()
2CO(g)+ O2(g)= 2CO2(g) ΔH=-566 kJ/mol,所以CO 的标准燃烧热ΔH4 =-283 kJ/mol;
(3)BaSO4(s)+4C(s,石墨) ![]() 4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol,图 1 为 1200K下, 恒容密闭容器中重晶石与石墨开始时都是固体, c(CO)随时间变化迅速增大,曲线图0-t1化学反应速率很快,t1-t2段时恒容密闭容器中压强增大,平衡逆向移动,所以c(CO)随时间变而减小。图 1 曲线 c(CO)在 0-t2 区间变化的原因:反应速率①比②大,故开始阶段c(CO)增大,后来反应②为主,故c(CO)减小 。
4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol,图 1 为 1200K下, 恒容密闭容器中重晶石与石墨开始时都是固体, c(CO)随时间变化迅速增大,曲线图0-t1化学反应速率很快,t1-t2段时恒容密闭容器中压强增大,平衡逆向移动,所以c(CO)随时间变而减小。图 1 曲线 c(CO)在 0-t2 区间变化的原因:反应速率①比②大,故开始阶段c(CO)增大,后来反应②为主,故c(CO)减小 。
A.BaSO4是固体,改变用量不会影响平衡移动,不会提高 BaS 的产率。故A错; B.①: BaSO4(s)+4C(s,石墨) ![]() 4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol ②: BaSO4(s)+4CO(g)
4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol ②: BaSO4(s)+4CO(g) ![]() 4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol,恒温恒容时, 当混合气体的密度不变, 反应①、②均达到化学平衡状态,故B对;C.CO2(g)和CO(g属于生成,减小初始浓度比
4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol,恒温恒容时, 当混合气体的密度不变, 反应①、②均达到化学平衡状态,故B对;C.CO2(g)和CO(g属于生成,减小初始浓度比![]() ,物,有利于增大 BaSO4 的转化率,故C正确;D.反应②为放热反应,而反应①为吸热反应,适当升高温度,对生成 BaS由利,故D错;
,物,有利于增大 BaSO4 的转化率,故C正确;D.反应②为放热反应,而反应①为吸热反应,适当升高温度,对生成 BaS由利,故D错;
(5)图1 中, t2 时刻将容器体积减小为一半,压强迅速增大一倍, t3 时刻达到新的平衡,曲线图为: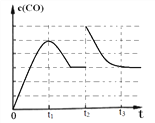
(6)SO2 做还原剂,MnO2做氧化剂,做阳极。阳极反应式Mn2+-2e-+2H2O =MnO2↓+4H+

【题目】该表是元素周期表中的一部分:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
4 |
回答下列问题:
(1)⑦是____________,原子半径最大的是____________。(填元素符号或化学式,下同)
(2)⑧⑨四种元素形成的简单离子,半径由大到小的顺序是________。
(3)上述元素中,最高价氧化物的水化物中,酸性最强的化合物的分子式是____________,碱性最强的化合物的电子式____________。
(5)①和氢元素形成的化合物很多,其中C2H6可用于形成燃料电池,若用NaOH作电解质溶液,写出该燃料电池的负极反应方程式____________。
(6)CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如表:
2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如表:
化学键 | C-H | C=O | H-H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应产生2molH2(g)时____________(填“放出”或“吸收”)热量为____________kJ。