题目内容
【题目】该表是元素周期表中的一部分:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
4 |
回答下列问题:
(1)⑦是____________,原子半径最大的是____________。(填元素符号或化学式,下同)
(2)⑧⑨四种元素形成的简单离子,半径由大到小的顺序是________。
(3)上述元素中,最高价氧化物的水化物中,酸性最强的化合物的分子式是____________,碱性最强的化合物的电子式____________。
(5)①和氢元素形成的化合物很多,其中C2H6可用于形成燃料电池,若用NaOH作电解质溶液,写出该燃料电池的负极反应方程式____________。
(6)CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如表:
2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如表:
化学键 | C-H | C=O | H-H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应产生2molH2(g)时____________(填“放出”或“吸收”)热量为____________kJ。
【答案】Si K S2->Cl->K+>Ca2+ ![]()
![]()
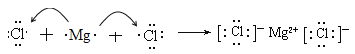 C2H6-14e-+18OH-=2CO32-+12H2O 吸收 120
C2H6-14e-+18OH-=2CO32-+12H2O 吸收 120
【解析】
根据元素在周期表中的位置可知①~分别是C、N、O、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br,据此解答。
(1)⑦是Si;根据元素周期律,同周期随着核电荷数增大,原子半径逐渐减小,同主族随着核电荷数增大,原子半径逐渐增大,原子半径最大的是K;
(2)相同的电子结构,质子数越大,离子半径越小,则⑧⑨四种元素形成的简单离子,半径由大到小的顺序是S2->Cl->K+>Ca2+;
(3)非金属性越强,最高价氧化物的水化物酸性越强,故最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;金属性越强,最高价氧化物的水化物碱性越强,故碱性最强的化合物KOH,电子式为![]() ;
;
(4)用电子式表示⑤和⑨组成的化合物氯化镁的形成过程为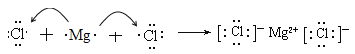 ;
;
(5)C2H6用于形成碱性燃料电池,作负极反应物生成CO32-,发生氧化反应,失电子,碳元素化合价从-3→+4,1个C2H6转移14个电子,故该燃料电池的负极反应方程式C2H6-14e-+18OH-=2CO32-+12H2O;
(6)按反应计量系数,该化学反应的反应热=反应物总键能-生成物总键能=(413×4+745×2-1075×2-436×2)kJ/mol=120 kJ/mol,则该反应产生2molH2(g)吸收热量为120kJ。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案