题目内容
11.现有某无色溶液,只可能含有下表中的几种离子.| 阳离子 | NH4+、Mg2+、K+、Al3+ |
| 阴离子 | HCO3-、MnO4-、SO42-、Cl- |
①取 l0mL该溶液于试管中滴加足量的Ba(NO3)2溶液,加稀硝酸酸化后过滤得到 0.03mol白色沉淀甲.
②取上述反应后的滤液,加人AgNO3溶液未见沉淀产生.
③另取l0mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加人NaOH的物质的量为0.03mol时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为0.224L(假设丙全部逸出),最后沉淀完全溶解.
下列推断不正确的是( )
| A. | 肯定没有 Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有 K+,且c(K+)=2mol/L | |
| C. | 该溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若仅根据实验③,将该溶液蒸干、灼烧,有可能得到仅含有氧化铝固体物质 |
分析 溶液无色,说明不含MnO4-;
①取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,说明甲为BaSO4,原溶液中含有SO42-;
②向滤液中加入AgNO3溶液未见沉淀产生,说明不含有Cl-;
③因为能与碱共热生成气体的只有NH4+,氢氧化镁不溶于氢氧化钠溶液,Al3+能与氢氧化钠溶液反应生成沉淀又能完全溶解,铝离子与碳酸氢根离子能发生双水解反应而不能大量共存,故不含HCO3-;根据氢氧化铝沉淀0.01mol和标况下氨气为0.224L,利用元素守恒可知有NH4+为0.01mol,Al3+为0.01mol,再根据电荷守恒可推知含有K+;则一定含有的离子为K+、NH4+、Al3+、SO42-,一定不含有的离子为MnO4-、Mg2+、Cl-、HCO3-.
解答 解:溶液无色,说明不含MnO4-;
①取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,说明甲为BaSO4,原溶液中含有SO42-,且物质的量为0.03mol;
②向滤液中加入AgNO3溶液未见沉淀产生,说明不含有Cl-;
③因为能与碱共热生成气体的只有NH4+,氢氧化镁不溶于氢氧化钠溶液,Al3+能与氢氧化钠溶液反应生成沉淀又能完全溶解,铝离子与碳酸氢根离子能发生双水解反应而不能大量共存,故不含HCO3-;根据氢氧化铝沉淀0.01mol和标况下氨气为0.224L,利用元素守恒可知有NH4+为0.01mol,Al3+为0.01mol,再根据电荷守恒可推知含有K+,且物质的量为0.03×2-0.01-0.01×3=0.02mol,综上所述可知一定含有的离子为K+、NH4+、Al3+、SO42-,一定不含有的离子为MnO4-、Mg2+、Cl-、HCO3-.
A.由上述分析可知,Mg2+、HCO3-、Cl-、MnO4-一定不存在,故A正确;
B.由上述分析可知,一定含有的离子为K+,物质的量为0.02mol,故浓度为:$\frac{0.02mol}{0.01L}$=2mol/L,故B正确;
C.由推断得出铵根的物质的量等于铝离子的物质的量,故不可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液,故C错误;
D.根据实验③得出的沉淀物质只有氢氧化铝,蒸干灼烧只得到氧化铝,故D正确;故选C.
点评 本题考查物质检验的实验方案的设计,为高频考点,把握实验中现象与结论的关系、发生的离子反应为解答的关键,注意电荷守恒的应用,题目难度中等.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 催化剂在化学反应前后,化学性质和质量都不变 | |
| C. | 催化剂不参加化学反应 | |
| D. | 任何化学反应,都需要催化剂 |
| A. | 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率 | |
| B. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢 | |
| D. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢 |
2CH3OH(g)═CH3OCH3(g)+H2O(g)
完成下列填空:
(1)有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式
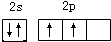 ;
;写出甲醇分子中官能团的电子式
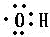 .
.(2)碳与同主族的短周期元素相比,非金属性较强的是C(填元素符号).写出一个能证明你的结论的化学方程式Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
(3)在温度和体积不变的情况下,能说明反应已达到平衡状态的是ac(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
(4)一定温度下,在三个体积约为2.0L的恒容密闭容器中发生上述反应:
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.40 | 0.16 | 0.16 |
| Ⅱ | 387 | 0.80 | a | |
| Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
a.及时移走产物 b.升高温度 c.充入CH3OHd.降低温度
②I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为$\frac{0.16}{t}$mol/(L.min)(用含t的式子表示).II号容器中a=0.32mol.
(5)若起始时向容器I中充入CH3OH 0.2mol、CH3OCH30.30mol和H2O 0.20mol,则反应将向正(填“正”“逆”)反应方向进行.
| A. | 随着反应的进行,CO32-在不断消耗 | |
| B. | 该电池的正极的反应式为:4OH-+4e-=O2+2H2O | |
| C. | 放电时CO32-向正极移动 | |
| D. | 该电池负极的反应为:H2+CO32--2e-=H2O+CO2 |
| A. | R一定是气态 | |
| B. | R一定是离子化合物 | |
| C. | R一定是共价化合物 | |
| D. | R可能是离子化合物,也可能是共价化合物 |
| A. | 加水振荡后用分液漏斗分离 | B. | 加溴水振荡后过滤 | ||
| C. | 加四氯化碳振荡后用分液漏斗分离 | D. | 加NaOH溶液振荡后用分液漏斗分离 |
| A. | 浓硫酸可做为H2、NH3等气体的干燥剂 | |
| B. | 胆矾遇浓硫酸变白是因为浓硫酸的脱水性 | |
| C. | 足量的锌与一定量的浓硫酸反应会生成氢气 | |
| D. | 可用铝罐储运热的浓硫酸、浓硝酸 |