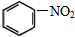题目内容
19.短周期元素A、B、C、D、E位于同周期且原子序数依次增大.已知A、C、E三种元素的原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应.D原子最外层的电子数的次外层的一半.请完成下列各小题:(1)A、B、C三种元素最高价氧化物对应水化物中,碱性最强的是NaOH(用化学式表示)
(2)指出元素E在元素周期表中的位置:第三周期第ⅥA族.
(3)元素C的氯化物属于共价化合物(填“离子”或“共价”)
(4)A、C元素的最高价氧化物对应水化物之间反应的离子方程式为OH-+Al(OH)3=AlO2-+H2O.
(5)在生活中,常利用C的单质与Fe2O3在高温下的反应来进行焊接钢轨.请写出该反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.该反应属于放热反应(填“吸热”或“放热”)
(6)D元素的单质在生产和生活中有广泛的应用,请写出工业上制备D单质(粗产品)的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.请举出D的单质在生产和生活中的一种应用半导体材料、太阳能电池.
分析 短周期元素A、B、C、D、E位于同周期且原子序数依次增大.A、C、E三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水,为氢氧化铝与强碱、强酸的反应,故A为Na、C为Al,B为Mg元素,E原子最外层电子数为10-1-3=6,则E为硫元素;D原子最外层的电子数是次外层的一半,处于第三周期,最外层电子数为4,故D为Si.
(1)金属性越强,最高价氧化物对应水化物的碱性越强;
(2)主族元素周期数=电子层数、主族族序数=最外层电子数;
(3)氯化铝属于共价化合物;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水;
(5)Al与氧化铁在高温下反应生成氧化铝与Fe,该反应为铝热反应,放出大量的热;
(6)工业上制备Si,用碳与二氧化硅反应生成Si与CO,硅是良好的半导体材料、可以用作太阳能电池等.
解答 解:短周期元素A、B、C、D、E位于同周期且原子序数依次增大.A、C、E三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水,为氢氧化铝与强碱、强酸的反应,故A为Na、C为Al,B为Mg元素,E原子最外层电子数为10-1-3=6,则E为硫元素;D原子最外层的电子数是次外层的一半,处于第三周期,最外层电子数为4,故D为Si.
(1)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,故答案为:NaOH;
(2)E为硫元素,原子有3个电子层,最外层电子数为6,处于周期表第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
(3)氯化铝属于共价化合物,故答案为:共价;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:OH-+Al(OH)3=AlO2-+H2O,故答案为:OH-+Al(OH)3=AlO2-+H2O;
(5)Al与氧化铁在高温下反应生成氧化铝与Fe,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应为铝热反应,放出大量的热,属于放热反应,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;放热;
(6)工业上用碳与二氧化硅反应制备硅,反应生成Si与CO,反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,硅是良好的半导体材料、可以用作太阳能电池等,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;半导体材料、太阳能电池.
点评 本题考查结构性质位置关系应用等,难度不大,推断元素是解题的关键,注意基础知识的理解掌握.

| A. | 8个中子的碳原子的核符号:12C | B. | CH4分子的比例模型: | ||
| C. | Cl离子的结构示意图: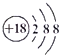 | D. | 氢氧化钠的电子式: |
| A. | 2SO2+O2?2SO3△H=-196.6kJ•mol-1 | |
| B. | C(g)+O2(g)=2CO△H=393.5kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ | |
| D. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 |
| A. | 实验室制取蒸馏水和用海水晒盐都利用了相同的物质分离方法 | |
| B. | 往盛有少量淀粉溶液的试管中加入一定量稀硫酸,加热3~4分钟后,再加入NaOH溶液至碱性,最后加入银氨溶液并水浴加热,有“银镜”出现 | |
| C. | 受强碱腐蚀致伤时,应先用大量水冲洗,再用2%的醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 | |
| D. | 采用比色的方法测定溶液颜色的深浅,根据溶液颜色与反应物浓度的关系,可换算成反应物在不同反应时刻的浓度 |
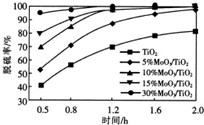 用TiO2负载MoO3催化剂使有机物R催化脱硫,负载MoO3的量对反应脱硫率的影响如图.下列说法正确的是( )
用TiO2负载MoO3催化剂使有机物R催化脱硫,负载MoO3的量对反应脱硫率的影响如图.下列说法正确的是( )| A. | 负载MoO3的量越大,平衡常数越大 | |
| B. | 当反应时间小于0.5h,脱硫率为0 | |
| C. | 1.6h负载MoO3的量为10%和15%的脱硫率相等 | |
| D. | 0.5~1.2h时,负载MoO3的量越大,脱硫速率越大 |
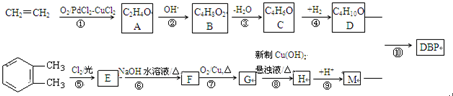
 .
. .
.

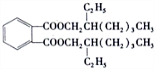 .
.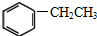 ④
④ ⑤CH3CH2CH=CH2 ⑥
⑤CH3CH2CH=CH2 ⑥