题目内容
17.下列变化中,能体现二氧化硫有还原性的是( )| A. | 将SO2气体通入含有氢氧化钠的酚酞溶液中,溶液褪色 | |
| B. | 将SO2气体通入澄清石灰水中,溶液变浑浊 | |
| C. | 将SO2通入品红溶液中,溶液褪色 | |
| D. | 将SO2气体通入碘水溶液中,溶液褪色 |
分析 能体现二氧化硫具有还原性,说明二氧化硫在反应中失电子化合价升高,作还原剂,还原剂体现还原性,据此分析解答.
解答 解:A.发生的反应为SO2+2NaOH=Na2SO3+H2O,该反应中各元素化合价不变,不属于氧化还原反应,故A错误;
B.SO2+Ca(OH)2=CaSO3↓+H2O,该反应中各元素化合价不变,不属于氧化还原反应,故B错误;
C.二氧化硫和有色物质反应生成无色物质而体现漂白性,故C错误;
D.SO2+I2+2H2O=H2SO4+2HI中S元素化合价由+4价变为+6价、I元素化合价由0价变为-1价,所以二氧化硫是还原剂、碘是氧化剂,则二氧化硫体现还原性,故D正确;
故选D.
点评 本题以二氧化硫为载体考查氧化还原反应,侧重考查基本理论,明确元素化合价变化是解本题关键,知道常见元素化合价,注意D中发生的反应,为易错点.

练习册系列答案
相关题目
8.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)25℃下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
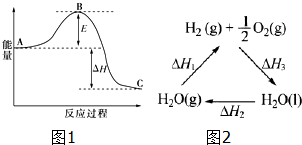
(2)合成氨反应:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),反应过程的能量变化如图1所示.已知N2(g)与H2(g)反应生成34gNH3(g),放出92.2kJ的热量.请回答下列问题:
该反应通常用铁作催化剂,加催化剂会使图中E变小(填“大”或“小”),图中△H=-46.1kJ/mol
(3)由气态基态原子形成1mol化学键释放的能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2(g)+3H2(g)═2NH3(g)△H=a kJ•mol-1.试根据表中所列键能数据估算a 的值:-93.
(4)已知:△H2=+44kJ•mol-1,△H3=-285.8kJ•mol-1图2列出它们之间的转变关系.请计算298K时由H2O(g)生成1molH2(g)和1/2molO2(g)反应的△H1=-(△H2+△H3)(用△H2、△H3表示△H1计算等式),+241.8kJ•mol-1(计算△H1数据结果).
(1)25℃下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol
(2)合成氨反应:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),反应过程的能量变化如图1所示.已知N2(g)与H2(g)反应生成34gNH3(g),放出92.2kJ的热量.请回答下列问题:
该反应通常用铁作催化剂,加催化剂会使图中E变小(填“大”或“小”),图中△H=-46.1kJ/mol
(3)由气态基态原子形成1mol化学键释放的能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(4)已知:△H2=+44kJ•mol-1,△H3=-285.8kJ•mol-1图2列出它们之间的转变关系.请计算298K时由H2O(g)生成1molH2(g)和1/2molO2(g)反应的△H1=-(△H2+△H3)(用△H2、△H3表示△H1计算等式),+241.8kJ•mol-1(计算△H1数据结果).

5.碱性锌锰干电池在放电时,电池的总反应方程式可以表示为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH.电池放电时,负极上发生反应的物质是( )
| A. | Zn | B. | 碳棒 | C. | MnO2 | D. | MnO2和H2O |
2.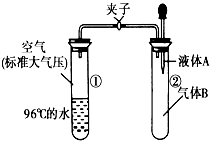 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了,则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 水、氨气 | ||
| C. | 氢氧化钠溶液、一氧化氮 | D. | 水、二氧化氮 |
9.既不能用浓硫酸干燥,又不能用碱石灰干燥的是( )
| A. | NH3 | B. | H2S | C. | SO2 | D. | HCl |
6.为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是( )
| A. | NaHCO3溶液(Na2CO3),应通入过量的CO2气体 | |
| B. | NaBr溶液(NaI),应加入适量的氯水、CCl4,进行萃取分液 | |
| C. | NH4Cl溶液(FeCl3),应加入适量的氨水,过滤 | |
| D. | CO2(CO),通过过量的灼热的氧化铜粉末 |
7.化学与社会、生活密切相关,下列现象或事实与对应的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 蔗糖、淀粉、纤维素等有甜味 | 人体内,糖类在淀粉酶的作用下能发生水解,生成葡萄糖 |
| B | 煤通过气化和液化等化学变化可以有效地控制酸雨 | 煤通过气化和液化处理,其产品中硫的含量将大大降低 |
| C | 地沟油经过处理加工后可用作飞机、汽车燃油 | 地沟油的成分是液态烃 |
| D | 在钢铁制品的表面镀上一层锡,可有效防止其被腐蚀 | 形成原电池时锡是负极被氧化,而钢铁制品作为正极被保护 |
| A. | A | B. | B | C. | C | D. | D |
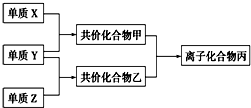 常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子.
常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子. ;
; 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题: