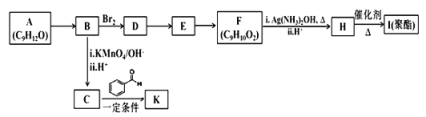
题目内容
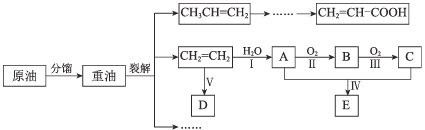
【题目】乙烯是来自石油的重要有机化工原料。结合以下路线回答:
已知:2CH3CHO + O22CH3COOH
(1)D是高分子,用来制造包装材料,其结构简式是_________________ 。
(2)E有香味,实验室用A和C反应来制取E
①反应IV的化学方程式是_______________________________________ 。
②实验结束之后,振荡收集有E的试管,有无色气泡产生其主要原因是(用化学方程式表示)______
(3)产物CH2=CH-COOH可能发生的反应有____________(填序号)。
a. 加成反应 b. 取代反应 c. 氧化反应 d. 中和反应
(4)①A是乙醇,与A相对分子质量相等且元素种类相同的有机物的结构简式是:_____、_____。
②为了研究乙醇的化学性质,利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。(加热、固定和夹持装置已略去)
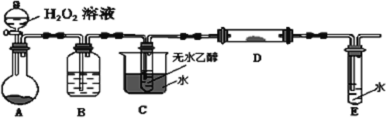
1)装置A圆底烧瓶内的固体物质是________,C中热水的作用是__________。
2)实验时D处装有铜粉,点燃D处的酒精灯后,D中发生的主要反应的化学方程式为__________,当反应进行一段时间后,移去酒精灯,D中仍然继续反应,说明D处发生的反应是一个________反应(填“吸热”或“放热”)。
【答案】![]() CH3COOH + C2H5OH
CH3COOH + C2H5OH![]() CH3COOC2H5 + H2O 2CH3COOH + Na2CO3=2CH3COONa + H2O + CO2↑ a b c d HCOOH CH3OCH3 MnO2 使乙醇汽化成乙醇蒸气 2CH3CH2OH+O22
CH3COOC2H5 + H2O 2CH3COOH + Na2CO3=2CH3COONa + H2O + CO2↑ a b c d HCOOH CH3OCH3 MnO2 使乙醇汽化成乙醇蒸气 2CH3CH2OH+O22![]() CH3CHO+2H2O 放热
CH3CHO+2H2O 放热
【解析】
乙烯与水经过步骤I发生加成反应生成乙醇,乙醇与氧气反应生成乙醛,乙醛氧化生成乙酸,乙酸与乙醇反应生成乙酸乙酯;乙烯发生加聚反应生成聚乙烯;
(1)D是高分子,用来制造包装材料,为聚乙烯,其结构简式为:![]() ;
;
(2)①E为乙酸乙酯,则乙醇与乙酸反应生成乙酸乙酯的方程式为:CH3COOH + C2H5OH![]() CH3COOC2H5 + H2O;
CH3COOC2H5 + H2O;
②加热时,挥发出的乙酸溶于乙酸乙酯中,振荡时与碳酸钠反应生成二氧化碳、水和乙酸钠,反应的方程式为:2CH3COOH + Na2CO3=2CH3COONa + H2O + CO2↑;
(3)CH2=CH-COOH含有的官能团为碳碳双键和羧基,可发生加成、氧化、加聚、还原和中和反应,故abcd全选;
(4)①乙醇的同分异构体为甲醚,乙醇分子去掉一个C、四个H时,可添加一个O,此时为甲酸;
②1)实验目的为乙醇的催化氧化,则装置A为制取氧气的装置,分液漏斗内盛有过氧化氢,则烧瓶内为催化剂二氧化锰;C中热水使乙醇变为蒸汽充分与氧气接触;
2)装置D中铜作催化剂,使乙醇蒸汽与氧气反应生成乙醛和水,反应的方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;一段时间后,移去酒精灯,D中仍然继续反应,说明该反应是一个放热反应,放出的热量能够维持反应持续进行。
2CH3CHO+2H2O;一段时间后,移去酒精灯,D中仍然继续反应,说明该反应是一个放热反应,放出的热量能够维持反应持续进行。

【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L1·s1
B. 在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,反应达到平衡时,压强为起始时的0.88倍
C. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L1,则反应的ΔH>0
D. 在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2,达到平衡时,N2O5的转化率大于20%