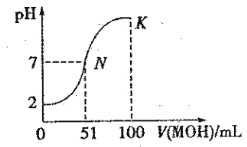
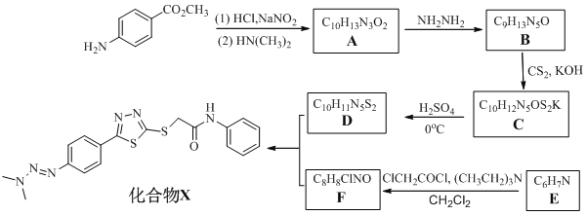
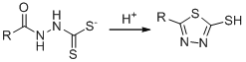题目内容
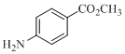
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4 溶液与Na2CO3 溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
(沉淀制备)称取 12.5 g 胆矾溶于 87.4 mL 蒸馏水中,滴 4 滴稀硫酸,充分搅拌后得到 CuSO4 溶液。向其中加入适 量 Na2CO3 溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是______________________。所得硫酸铜溶液的溶质质量分数约 为______________________。
(2)用无水乙醇洗涤的目的是______________________。
(实验探究)同学们设计了如下装置,用制得的蓝绿色固体进行实验:
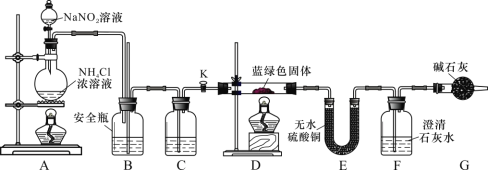
(3)D 装置加热前,需要首先打开活塞 K,用 A 装置制取适量 N2,然后关闭 K,点燃 D 处酒精灯。A 中产生N2 的作用是______________________,C 中盛装的试剂应是______________________。
(4)装置 A 中发生反应的离子方程式为______________________。
(5)若蓝绿色固体的组成为 xCuCO3·yCu(OH)2,实验能观察到的现象是_______________________________________。
(6)同学们查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用 Ba(OH)2 代替 Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是 ______________。
a.Ba(OH)2 的碱性比 Ca(OH)2 强
b.Ba(OH)2 溶解度大于 Ca(OH)2,能充分吸收 CO2;
c.相同条件下,CaCO3 的溶解度明显大于 BaCO3
d.吸收等量 CO2 生成的 BaCO3 的质量大于 CaCO3,测量误差小
待 D 中反应完全后,打开活塞 K,再次滴加 NaNO2 溶液产生 N2,其目的是 ________________________________________。若定量分析所取蓝绿色固体质量为 27.1 g,装置 F 中使用 Ba(OH)2 溶液,实验结束后, 装置 E 的质量增加 2.7 g,F 中产生沉淀 19.7 g。则该蓝绿色固体的化学式为 ____________________。
【答案】抑制 Cu2+ 水解,防止溶液变浑浊 8.0% 或 0.08 利用乙醇易挥发的性质带走沉淀上面的水 排除装置中的空气,避免干扰 浓硫酸 NO2-+NH4+= N2 ↑+2H2O 硬质玻璃管中蓝绿色固体变黑色,E 中白色固体变蓝,F 中溶液变浑浊 b d 让停留在装置中的气体被充分吸收,减小实验误差 2CuCO33Cu(OH)2 或 3Cu(OH)22CuCO3 或 Cu5(OH)6(CO3)2
【解析】
根据水解原理及质量分数表达式分析解答;根据实验装置、目的及物质性质分析解答;根据氧化还原反应原理分析解答;根据Ksp及反应方程式进行相关计算,分析解答。
(1)铜离子水解,加酸抑制其水解;12.5g胆矾中含有硫酸铜的质量为![]() ,87.4mL蒸馏水的质量为87.4g,则溶液的质量为12.5g+87.4g=99.9g,所得硫酸铜溶液的溶质质量分数为
,87.4mL蒸馏水的质量为87.4g,则溶液的质量为12.5g+87.4g=99.9g,所得硫酸铜溶液的溶质质量分数为![]() ;故答案为:抑制Cu2+水解,防止溶液变浑浊;8.0% 或 0.08;
;故答案为:抑制Cu2+水解,防止溶液变浑浊;8.0% 或 0.08;
(2)乙醇易挥发,可带走沉淀上面的水;故答案为:利用乙醇易挥发的性质带走沉淀上面的水;
(3)通入N2的目的是排除装置中的空气,C瓶装浓硫酸干燥氮气;故答案为:排除装置中的空气,避免干扰;浓硫酸;
(4)A中的反应为亚硝酸根与铵根离子价态归中生成氮气,发生的离子方程式为:
NO2-+NH4+= N2 ↑+2H2O;故答案为:NO2-+NH4+= N2 ↑+2H2O;
(5)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,则分解生成黑色氧化铜、水、二氧化碳,则硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊;故答案为:硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊;
(6)Ba(OH)2溶解度大于Ca(OH)2,充分吸收CO2,BaCO3的摩尔质量大于CaCO3,测量误差小;氢氧化钙为强碱,CaCO3的溶解度和BaCO3溶解度相差不大;待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是让停留在装置中的气体被充分吸收,减小实验误差;E中吸收的是水,水的物质的量为![]() =0.15mol,F中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量为
=0.15mol,F中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量为![]() =0.1mol,氧化铜的物质的量=
=0.1mol,氧化铜的物质的量=![]() ═0.25mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25mol:0.3mol:0.1mol=5:6:2,所以其化学式为:2CuCO3·3Cu(OH)2或3Cu(OH)2·2CuCO3或Cu5(OH)6(CO3)2;
═0.25mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25mol:0.3mol:0.1mol=5:6:2,所以其化学式为:2CuCO3·3Cu(OH)2或3Cu(OH)2·2CuCO3或Cu5(OH)6(CO3)2;
故答案为:b d;让停留在装置中的气体被充分吸收,减小实验误差;2CuCO33Cu(OH)2 或 3Cu(OH)22CuCO3 或 Cu5(OH)6(CO3)2。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
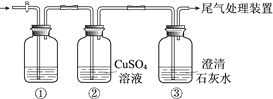
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A.③中白色浑浊是CaCO3
B.②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C.实验Ⅰ①中发生的反应是:CO2+H2O+ S2== CO32+ H2S
D.由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
【题目】下列用来解释实验事实的相关平衡方程式不正确的是
实验事实 | 相关平衡 | |
A | 加入NaHCO3使氯水的漂白能力增强 | Cl2+H2O |
B | 配制FeCl3溶液时加少量盐酸 | Fe3++3OH- |
C | 溶有CO2的正常雨水pH≈5.6 | H2O+CO2 |
D | CaCO3固体溶于盐酸 | CaCO3(s) |
A. A B. B C. C D. D