题目内容
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
Ⅰ.以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图所示:
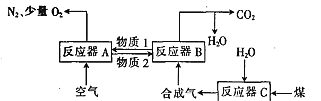
①C(s) +H2O(g) = CO(g)+ H2(g) ΔH = akJmol-1
②CO(g)+ H2(g) + O2(g) = CO2(g) +H2O(g) ΔH = bkJmol-1
(1)写出图中总反应的热化学方程式:_____________________________
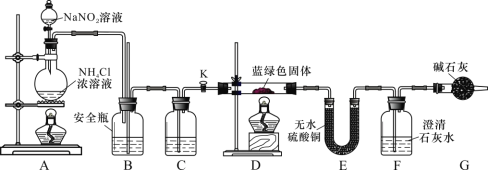
(2)空气经反应器A后得到的尾气___________(填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____________________。
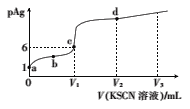
Ⅱ.用FeO作载氧剂,部分反应的lgKp [K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图所示。
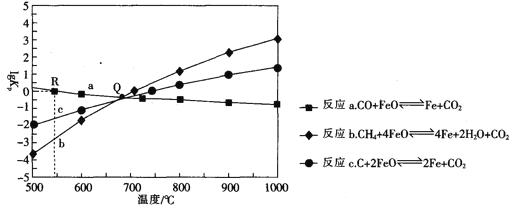
(3)图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________.
CO2(g) +Fe(s),则CO的平衡转化率为______________.
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp = _____________________.
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大”“减小”或“不变”)。
【答案】C(s) O2(g) = CO2(g) ΔH = (a + b)kJmol-1 不能 经反应器A得到的尾气中含有少量氧气,氧气与氢气混合可能发生爆炸 bc 50% P02 正反应 增大
【解析】
Ⅰ(1)应用盖斯定律进行计算。
(2)空气经反应器A后得到的尾气,尾气是氮气和少量氧气的混合物,和氢气接触,氢气和氧气容易发生爆炸。
Ⅱ(3)反应a,升高温度,lgKp减小,Kp减小;反应b、c,升高温度,lgKp增大,Kp增大,再分析每一个反应平衡移动得出结论。
(4)建立“三步走”,再计算压强平衡常数,最后得出结论。
Ⅲ(5)先建立“三步走”,计算消耗的量,再根据压强平衡常数进行计算。
(6)利用压强之比等于物质的量之比,得出此时压强,再根据计算此时的压强常数,与平衡压强常数比较,再得出结论。
(7)利用相当于改变压强的情况来分析平衡怎样移动,得出平衡转化率变化。
Ⅰ(1)应用盖斯定律,第一个方程式加上第二个方程式,得到总反应的热化学方程式:C(s) O2(g) = CO2(g) ΔH = (a + b)kJmol-1,故答案为:C(s) O2(g) = CO2(g) ΔH = (a + b)kJmol-1。
(2)空气经反应器A后得到的尾气,尾气是氮气和少量氧气的混合物,和氢气接触,氢气和氧气容易发生爆炸,因此不能直接用作工业合成氨的原料气,原因是经反应器A得到的尾气中含有少量氧气,氧气与氢气混合可能发生爆炸,故答案为:不能;经反应器A得到的尾气中含有少量氧气,氧气与氢气混合可能发生爆炸。
Ⅱ(3)反应a,升高温度,lgKp减小,Kp减小,平衡逆向移动,逆向是吸热反应,正向为放热反应,反应b、c,升高温度,lgKp增大,Kp增大,平衡正向移动,正向是吸热反应,即属于吸热反应的是反应b、c,故答案为:b、c。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,lgKp=0,Kp=1。

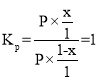
解得x = 0.5mol
![]() ,则CO的平衡转化率为50%,故答案为:50%。
,则CO的平衡转化率为50%,故答案为:50%。
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
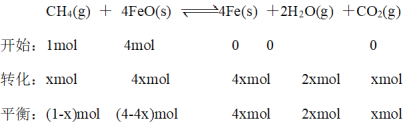
根据压强之比等于物质的量之比,P0:2P0=1mol:(1-x+2x+x)mol,解得x=0.5mol,
(5)T℃下,该反应的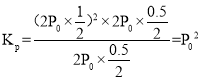 ,故Kp = P02,故答案为:P02。
,故Kp = P02,故答案为:P02。
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时物质的量是原来的2.5倍,因此压强是原来的2.5倍,此时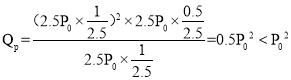 ,因此反应向正反应方向进行,故答案为:正反应。
,因此反应向正反应方向进行,故答案为:正反应。
(7)将该容器改为恒压密闭容器,容器体积变大,相当于在原来容器基础上减小压强,平衡正向移动,CH4的平衡转化率增大,故答案为:增大。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案