题目内容
【题目】在含3molNaHSO3的溶液中加入含a mol NaIO3的溶液充分反应(不考虑I2+I-![]() I3-),所得溶液中的I-与加入NaIO3的物质的量的关系曲线如右图所示,下列说法不正确的是
I3-),所得溶液中的I-与加入NaIO3的物质的量的关系曲线如右图所示,下列说法不正确的是
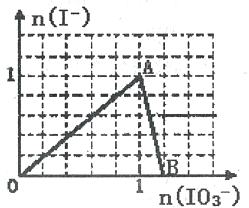
A. 还原性HSO3->I-,氧化性:IO3->SO42- >I2
B. 当a=1时,溶液中n(I2):n(I-)=3:5
C. AB段,反应的离子方程式为:IO3-+5I-+ 6H+ =3I2+3H2O
D. l<a<1.2时,溶液中SO42-与I-的物质的量之比为3:(6-5a)
【答案】A
【解析】A、0~1时溶液中I-浓度增大,发生的反应是IO3-+3HSO3-=I-+3SO42-+3H+,根据氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性,IO3-中I的化合价降低,作氧化剂,HSO3-中S的化合价升高,HSO3-作还原剂,即氧化性:IO3->SO42-,还原性:HSO3->I-,n(IO3-)=1以后,发生离子反应方程式为:IO3-+5I-+6H+=3I2+3H2O,氧化性IO3->I2,SO42-化合价没有变化,无法判断SO42-的氧化性与I2氧化性强弱,故说法错误;B、当a=1时,溶液中n(I-)=1mol,溶液中含有n(IO3-)=0.1mol,然后发生IO3-+5I-+6H+=3I2+3H2O,IO3-完全反应,消耗n(I-)=0.5mol,生成n(I2)=0.3mol,溶液中n(I-)=0.5mol,因此n(I2):n(I-)=0.3:0.5=3:5,故说法正确;C、根据选项A的分析,故说法正确;D、n(SO42-)=3mol,A点时溶液中n(IO3-)=(a-1)mol,n(I-)=1mol,1~1.2时,剩余n(I-)=[1-5(a-1)]mol=(6-5a)mol,因此n(SO42-):n(I-)= 3:(6-5a),故说法正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案