题目内容
【题目】向一体积为2L的恒温恒容密闭容器中充入一定量的H2和N2,发生反应:N2(g)+ 3H2(g) ![]() 2NH3(g) △H=a kJmol-1。体系中气体的物质的量随时间的变化如图所示。
2NH3(g) △H=a kJmol-1。体系中气体的物质的量随时间的变化如图所示。
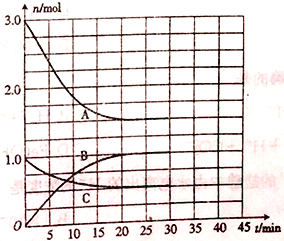
(1)表示N2浓度变化的曲线是________(填“A”“ B”或“C”),25min时,c(NH3)= ______。
(2)0~20min内,v(H2)= ______。若该过程中反应放出的热量为47.2kJ,则a=______。
(3)30min时,向容器中再充入一定量的NH3,一段时间后,与原化学平衡状态时的反应速率相比,正反应速率______(填“增大”“ 减小”或“不变”,下同),逆反应速率_______________。
【答案】 C 0.5mol·L-1 0.0375mol·L-1·.min-1 -94.4 增大 增大
【解析】本题考查化学反应速率计算、影响化学反应速率的因素,(1)根据题中信息,N2是反应物,其浓度应是减小,应从A和C选择,化学反应速率之比等于化学计量数之比,v(N2)=1/3v(H2),因此表示N2浓度变化的曲线是C,表示NH3的曲线是B,根据图像,20min时达到平衡,即NH3的浓度为1.0/2mol·L-1=0.5mol·L-1;(2)根据上述分析,A曲线代表H2的变化,0-20min时,消耗氢气物质的量为(3-1.5)mol=1.5mol,根据化学反应速率数学表达式,v(H2)=1.5/(2×20)mol/(L·min)=0.0375 mol/(L·min),此反应是放热反应,消耗3mol氢气,放出的热量47.2×3/1.5kJ=94.4kJ,因此a=-94.4;(3)30min时,再充入一定量的氨气,相当于在原来的基础上增大压强,增大压强,反应速率加快,即正逆反应速率都增大。

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是__________________。