��Ŀ����
����Ŀ��H2��CO��CH4��CH3OH�ȶ�����Ҫ����Դ��Ҳ����ҪΪ����ԭ�ϡ�
��1����֪25�棬1.01��105Paʱ��,8.0DgCH4��ȫȼ�����ɶ�����̼�����Һ̬ˮ�ų�444.8kJ������дɽ�÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ��____________________��
��2��Ϊ���������ܼ�����������̼�����������ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����ҵ�Ͽ�����CO2������ȼ�ϼ״���
�����Ϊ2L���ܱ������У�����lmolCO2��3molH2��һ�������·�����Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)�������CO2��CH3OH(g)�����ʵ�����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g)�������CO2��CH3OH(g)�����ʵ�����ʱ��仯��ͼ��ʾ��
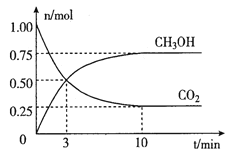
�ٴӷ���ʼ��ƽ����CO2��ƽ����Ӧ����v(CO2)=____��
�ڴﵽƽ��ʱ��H2��ת����Ϊ__________��
�����д�ʩ������߷�Ӧ���ʵ���__________��
A.�����¶� B.������� C.����ѹǿ D.��ʱ�����CH3OH
��3����ҵ��Ҳ��CO��H2Ϊԭ���Ʊ�CH3OH����Ӧ����ʽΪ��CO(g)+2H2(g)![]() CH3OH(g)����һ����̶����ܱ�������Ͷ��һ������CO��H2�������������Ӧ��������������˵��������Ӧ�ﵽƽ��״̬����______��
CH3OH(g)����һ����̶����ܱ�������Ͷ��һ������CO��H2�������������Ӧ��������������˵��������Ӧ�ﵽƽ��״̬����______��
A.��Ӧ��CO��CH3OH�����ʵ���֮��Ϊ1:1
B.��������ѹǿ����ʱ��ı仯���仯
C.��λʱ����ÿ����1molCO��ͬʱ����1mclCH3OH
D.CH3OH�����������ڻ�������б��ֲ���
E.���������ܶȱ��ֲ���
���𰸡� CH4(g)+2O2(g)=CO2(g)+2H2O(1)��H=-889.6kJ/mol 0.0375mol/(L��min) 75% D BD
��������(1)0.5mol������ȫȼ�շ���444.8kJ��1mol������ȫȼ�շ���889.6kJ���ݴ�д��������ȫȼ�յ��Ȼ�ѧ��ʽ��
��2����������ʽ���ⷨ������ؼ��㣬�����Ӧ�б仯����ƽ����������v=c/t����������������ƽ��Ũ���ж�ת�������ʵ���,�����ɼ���ת������
��3������Ӧ�ﵽƽ��״̬ʱ,�����淴Ӧ�������(ͬ������),�����ʵ�Ũ�ȡ��������ٸı�,�Լ��ɴ�������һЩ������Ҳ�������Դ˽����ж���
��1��8.0gCH4����Ϊ0.5mol����ȫȼ�����ɶ�����̼�����Һ̬ˮ�ų�444.8kJ������1molCH4��ȫȼ�����ɶ�����̼�����Һ̬ˮ�ų�889.6kJ�������Ȼ�ѧ����ʽΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(1)��H=-889.6kJ/mol����ȷ����CH4(g)+2O2(g)=CO2(g)+2H2O(1)��H=-889.6kJ/mol��
��2����������ʽ���ⷨ����:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��ʼ�� 1 3 0 0
�仯�� 0.75 2.25 0.75 0.75
ƽ���� 0.25 0.75 0.75 0.75
�ٷ�Ӧ��ƽ����CO2��ƽ����Ӧ����v(CO2)=0.75/2��10= 0.0375mol/(L��min)����ȷ����0.0375mol/(L��min)��
�ڴﵽƽ��ʱ��H2��ת����Ϊ2.25/3��100%=75%����ȷ����75%��
��A.�����¶�����Ӧ���ʼӿ���������B.�������������̶ȵؼӿ췴Ӧ������������C.����ѹǿ����С�������������Ũ������Ӧ���ʼӿ���������D.��ʱ�����CH3OH����С������Ũ������Ӧ���ʼ�������ȷ����ȷѡ��D��
��3��A.ƽ��ʱ��Ӧ��������ֵ����ʵ�������,������ֵ����ʵ�����һ�����,A������B.��Ϊ�÷�ӦΪ����������С�ķ�Ӧ���淴Ӧ���л�����������ʵ��������仯,��������ѹǿ����ʱ��ı仯���仯,˵����������ܵ����ʵ����ٲ���,˵����Ӧ����ƽ��,B��ȷ��C.��λʱ��������1molCO,ͬʱ����1molCH3OH,����ʾ����Ӧ����,��Ӧʼ�հ��˹�ϵ����,����˵������ƽ��, C������D.CH3OH�����������ڻ�������б��ֲ�����˵�����淴Ӧ�������������ƽ��״̬, D��ȷ��E.��Ӧǰ������������������������������������������ܶ�ʼ��Ϊ��ֵ�������ж���Ӧ�ﵽƽ��״̬��E��������ȷѡ��BD��