题目内容
7.在Na2O2与CO2的反应力,每生成5.6L O2(标况)时,转移电子数为( )| A. | 2个 | B. | 0.25mol | C. | 3.01×1023个 | D. | 1mol |
分析 过氧化钠和二氧化碳反应方程式为2Na2O2+2CO2=2Na2CO3+O2,该反应Na2O2中O元素化合价由-1价变为0价和-2价,生成22.4L氧气需要转移2NA个电子,根据氧气和转移电子之间的关系式计算.
解答 解:过氧化钠和二氧化碳反应方程式为2Na2O2+2CO2=2Na2CO3+O2,该反应Na2O2中O元素化合价由-1价变为0价和-2价,生成22.4L氧气需要转移2NA个电子,
设转移电子数为x,
2Na2O2+2CO2=2Na2CO3+O2 转移电子数
22.4L 2NA
5.6L x
22.4L:2NA=5.6L:x
x=$\frac{2{N}_{A}×5.6L}{22.4L}$=0.5NA=3.01×1023,其物质的量是0.5mol,
故选C.
点评 本题考查氧化还原反应的有关计算,明确各个物理量之间的关系式是解本题关键,注意该反应中元素化合价变化,为易错点.

练习册系列答案
相关题目
20.将a g二氧化锰粉末加入cL b mol•L-1的浓盐酸中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 可以收集到氯气$\frac{22.4b}{2{N}_{A}}$L | B. | 反应后Cl-数目为bc-d | ||
| C. | NA可表示为$\frac{87d}{2a}$ | D. | 反应后溶液中的H+数目为bc-2d |
1.“保护环境,就是保护人类自己.”下列环境问题与其产生的主要原因不相符的是( )
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NOx等引起的
③“赤潮”主要是由水体中P、N等元素过量引起的
④“白色污染”主要是由聚乙烯塑料等引起的
⑤“酸雨”主要是由空气中CO2浓度增大引起的
⑥“温室效应”主要是由空气中CO2浓度增大引起的.
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NOx等引起的
③“赤潮”主要是由水体中P、N等元素过量引起的
④“白色污染”主要是由聚乙烯塑料等引起的
⑤“酸雨”主要是由空气中CO2浓度增大引起的
⑥“温室效应”主要是由空气中CO2浓度增大引起的.
| A. | 只有① | B. | 只有②③⑤ | C. | 只有⑤ | D. | 全部 |
15.下列关于有机物的说法正确的是( )
| A. | 甲烷和苯都能发生氧化反应和取代反应 | |
| B. | 乙烯和聚氯乙烯都能发生加成反应 | |
| C. | 乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 | |
| D. | 淀粉、纤维素水解的最终产物互为同分异构体 |
12.C2H5OH的官能团-OH,含有-OH的物质具有与乙醇类似的化学性质,在Cu或Ag的催化下,下列物质不能与O2发生氧化反应的是( )
| A. | CH3CH2CH2CH2OH | B. |  | C. | 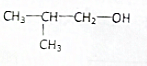 | D. | 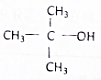 |

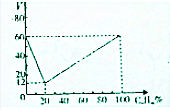 分子式为CnHm的烃与氢气在一定条件下加成,生成分子式为CnHm+a的烷(在反应温度时,CnHm和CnHm+a均为气态),若取不同比例的CnHm和H2混合气60mL、反应后气体总体积V与混合气中CnHm的体积分数如图所示.则CnHm+a中的a值为( )
分子式为CnHm的烃与氢气在一定条件下加成,生成分子式为CnHm+a的烷(在反应温度时,CnHm和CnHm+a均为气态),若取不同比例的CnHm和H2混合气60mL、反应后气体总体积V与混合气中CnHm的体积分数如图所示.则CnHm+a中的a值为( )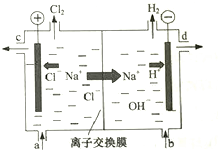 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过. CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
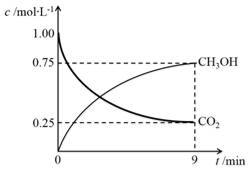
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。 CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。