题目内容
某化合物中含X,Y,Z三种元素,X为一种金属元素,其原子个数组成比为X∶Y∶Z=1∶2∶4.将1.98g该化合物溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,恰好完全反应产生Fe2+.向反应后的溶液中加入适量KOH溶液使Fe2+刚好沉淀完全,过滤,将沉淀充分加热后,得到红色Fe2O3粉末2.4g.将滤液在一定条件下蒸干,只能得到一种纯净不含结晶水的含氧酸盐(不为复盐)6.96g.试通过计算推断该化合物的化学式.
答案:
解析:
解析:
|
解:原化合物中含铁元素为: 蒸干滤液后所得含氧酸盐为K2SO4. n(K+)= 沉淀: Fe2+需加KOH为:2×0.03mol=0.06mol 故原化合物中含K+为: 0.08mol-0.06mol=0.02mol 则原化合物含另一种元素为非金属元素(显负价),其质量为: 1.98g-(0.02mol×39g/mol+0.01mol×56g/mol)=0.64g 若铁为X,钾为Y,Z为非金属元素. 所以n(X)∶n(Y)∶n(Z)=0.01mol∶0.02mol∶z mol=1∶2∶4 所以Z元素的物质的量为0.04mol. 所以Z的摩尔质量为: 所以原化合物的化学式为K2FeO4. |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
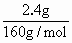 ×2-
×2-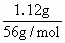 =0.01mol
=0.01mol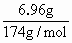 ×2=0.08mol
×2=0.08mol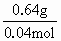 =16g/mol,Z为氧元素.
=16g/mol,Z为氧元素.