题目内容
中学化学常见部分元素原子结构及性质如表所示:
(1)①A元素在周期表中的位置为 .
②检验某溶液中含A的低价离子而不含其高价离子的方法是 .
(2)B与C形成的化合物的电子式为 .
(3)①F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y,区别X与Y的实验方法是 .
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则N的结构式为 .
(4)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写) .
(5)(在25℃、101kPa下,已知D的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,该反应的热化学方程式是 .
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子K、L、M层电子数之比是1:4:1 |
| ③ | C | C是活泼非金属元素,其单质常温下呈气态但化学性质稳定 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有正化合价,A、C、F都能与E形成二种或二种以上化合物 |
| ⑥ | F | F元素的一种核素没有中子 |
②检验某溶液中含A的低价离子而不含其高价离子的方法是
(2)B与C形成的化合物的电子式为
(3)①F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y,区别X与Y的实验方法是
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则N的结构式为
(4)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写)
(5)(在25℃、101kPa下,已知D的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,该反应的热化学方程式是
分析:A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,为变价金属,则A为Fe;B原子K、L、M层电子数之比是1:4:1,K层容纳2个电子,则K、L、M层电子数分别为2、8、2,故B为Mg;C是活泼非金属元素,其单质常温下呈气态但化学性质稳定,则C为N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,则D为Si元素;F元素的一种核素没有中子,则F为H元素;通常情况下,E没有正化合价,A、C、F都能与E形成二种或二种以上化合物,则E为O元素,据此解答.
解答:解:A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,为变价金属,则A为Fe;B原子K、L、M层电子数之比是1:4:1,K层容纳2个电子,则K、L、M层电子数分别为2、8、2,故B为Mg;C是活泼非金属元素,其单质常温下呈气态但化学性质稳定,则C为N元素;D单质被誉为“信息革命的催化剂”,是常用的半导体材料,则D为Si元素;F元素的一种核素没有中子,则F为H元素;通常情况下,E没有正化合价,A、C、F都能与E形成二种或二种以上化合物,则E为O元素,
(1)①A为Fe元素,处于周期表中第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
②取其溶液,加入KSCN溶液,不显色,再滴入氯水,显红色,说明溶液中含亚铁离子不含铁离子,
故答案为:取其溶液,加入KSCN溶液,不显色,再滴入氯水,显红色;
(2)B与C形成的化合物为Mg3N2,属于离子化合物,其电子式为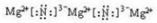 ,
,
故答案为: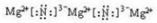 .
.
(3)①H与O可以形成原子个数比分别为2:1、1:1的两种化合物X和Y,则X为H2O、Y为H2O2,区别X与Y的实验方法是:分别取X、Y各少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2,无明显现象的是H2O,
故答案为:分别取X、Y各少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2,无明显现象的是H2O;
②H与N组成的两种化合物M和N所含的电子数分别与H2O、H2O2相等,则M为NH3、N为N2H4,N2H4中N原子之间形成1对共用电子对,H原子与N原子之间形成1对共用电子对,则N2H4的结构式为 ,
,
故答案为: ;
;
(4)有人认为Mg、Si的单质用导线连接后插入NaOH溶液中,硅与氢氧化钠溶液反应生成硅酸钠、氢气,可以形成原电池,负极Si失去电子在碱性条件下生成硅酸根、水,负极电极方程式为:Si+6OH--4e-=SiO32-+3H2O,
故答案为:Si+6OH--4e-=SiO32-+3H2O;
(5)在25℃、101kPa下,已知D的气态氢化物SiH4,在氧气中完全燃烧后恢复至原状态,生成二氧化硅(s)与液体水,反应中Si元素由-4价升高为+4,1molSiH4反应转移电子8mol,平均每转移1mol电子放热190.0kJ,则1molSiH4反应放出热量为190.0kJ×8=1520.0 kJ,故该反应的热化学方程式为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=-1520.0 kJ/mol,
故答案为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=-1520.0 kJ/mol.
(1)①A为Fe元素,处于周期表中第四周期第Ⅷ族,
故答案为:第四周期第Ⅷ族;
②取其溶液,加入KSCN溶液,不显色,再滴入氯水,显红色,说明溶液中含亚铁离子不含铁离子,
故答案为:取其溶液,加入KSCN溶液,不显色,再滴入氯水,显红色;
(2)B与C形成的化合物为Mg3N2,属于离子化合物,其电子式为
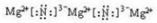 ,
,故答案为:
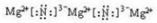 .
.(3)①H与O可以形成原子个数比分别为2:1、1:1的两种化合物X和Y,则X为H2O、Y为H2O2,区别X与Y的实验方法是:分别取X、Y各少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2,无明显现象的是H2O,
故答案为:分别取X、Y各少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2,无明显现象的是H2O;
②H与N组成的两种化合物M和N所含的电子数分别与H2O、H2O2相等,则M为NH3、N为N2H4,N2H4中N原子之间形成1对共用电子对,H原子与N原子之间形成1对共用电子对,则N2H4的结构式为
 ,
,故答案为:
 ;
;(4)有人认为Mg、Si的单质用导线连接后插入NaOH溶液中,硅与氢氧化钠溶液反应生成硅酸钠、氢气,可以形成原电池,负极Si失去电子在碱性条件下生成硅酸根、水,负极电极方程式为:Si+6OH--4e-=SiO32-+3H2O,
故答案为:Si+6OH--4e-=SiO32-+3H2O;
(5)在25℃、101kPa下,已知D的气态氢化物SiH4,在氧气中完全燃烧后恢复至原状态,生成二氧化硅(s)与液体水,反应中Si元素由-4价升高为+4,1molSiH4反应转移电子8mol,平均每转移1mol电子放热190.0kJ,则1molSiH4反应放出热量为190.0kJ×8=1520.0 kJ,故该反应的热化学方程式为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=-1520.0 kJ/mol,
故答案为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l)△H=-1520.0 kJ/mol.
点评:考查元素化合物推断、电子式、原电池原理、热化学方程式书写、离子检验与实验方案设计等,题目综合性较大,推断元素是解题关键,需要学生全面掌握基础知识,(2)中电子式书写为易错点.

练习册系列答案
相关题目
 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).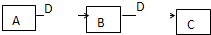 (2009?潍坊一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素.在一定条件下相互转化关系如下图所示(部分产物已略去).请按要求回答下列问题:
(2009?潍坊一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素.在一定条件下相互转化关系如下图所示(部分产物已略去).请按要求回答下列问题: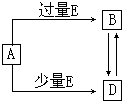 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).