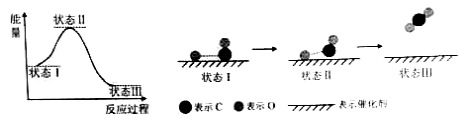
��Ŀ����
����Ŀ��ijͬѧ�ú������������������ƹ��壬��ȡâ����Na2SO4��10H2O������������ͼ������ʾ����ش��������⣺
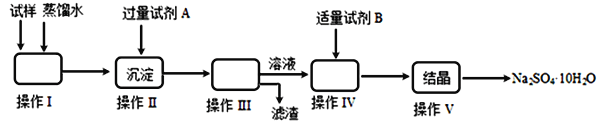
��1������I��������________������III����IJ���������________________________��
����V�IJ���������________���ñ�����룩
���� b.��ȴ c.����Ũ�� d.�������ӽ�����
��2���Լ�AΪ__________���Լ�BΪ__________�������Լ�B��Ŀ����__________________��ʵ���м��������Լ�B��ʵ�鷽��Ϊ___________________��
�ⶨ���ò�Ʒ�нᾧˮ������ʵ����̼�����������������������
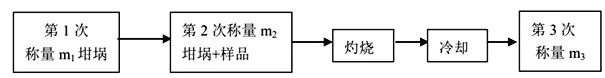
��3���������ò�Ʒ�нᾧˮ�����ı���ʽΪ___________________
��4�����в����ᵼ�½��ƫ�ߵ���______________��ѡ���ţ�
a.����δ���� b.���ȹ������о��彦ʧ c.�����к����ӷ�����
���𰸡� �ܽ� �ձ�����������©�� cba NaOH ���� ��ȥ�������м��������NaOH �ٵμ�����Ĺ����У�������pH��ֽ����pH�ƣ��ⶨ��Һ��pH���պ�Ϊ7 ![]() ab
ab
����������1��������������Ϊ�ܽ���壬���� III�ǹ��˲������ݴ�ѡ������IJ�������Ϊ���ձ�����������©����
��2������������֪AΪ����������������Һ��BΪϡ������Һ������ϡ�����ȥ���� II�м��������NaOH�����òⶨ��ҺPH�ķ����ж��Ƿ�ǡ���к�ʣ���������ƣ�ʵ���м��������Լ�B��ʵ�鷽��Ϊ���ڵμ�����Ĺ����У�������pH��ֽ����pH�ƣ��ⶨ��Һ��pH���պ�Ϊ7��
��3����Ʒ������Ϊ��m2-m1��g����Ʒ�������Ƶ�����Ϊ��m3-m1��g����ˮ������Ϊ��m2-m1��g-��m3-m1��g=��m2-m3��g�����ò�Ʒ�нᾧˮ�����ı���ʽΪ![]() ��
��
��4��a.����δ�������ƷС�����ɵ�ˮƫ�࣬�ⶨ���ƫ�ߣ���a��ȷ��b.���ȹ������о��彦ʧ���������ɵ�ˮƫ�࣬�ⶨ���ƫ�ߣ���b��ȷ�� c.�����к����ӷ����ʣ��������ɵ�ˮƫС���ⶨ���ƫ�ͣ���c����Ϊab��

����Ŀ����1����֪25 ��ʱ�й�����ĵ���ƽ�ⳣ����
���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | K1=4.3��10-7 K2=5.6��10-11 |
�� ͬ�¶��£���pHֵ��a. NaHCO3��b. NaCN��c��Na2CO3��Һ�����ʵ���Ũ���ɴ�С��˳��Ϊ__________������ţ���
�� 25 ��ʱ����20mL 0.1mol/LCH3COOH��Һ��20mL0.1mol/LHSCN��Һ�ֱ���20ml0.1mol/L NaHCO3��Һ��ϣ�ʵ���ò������������(V)��ʱ��(t)�ı仯��ͼ��ʾ��
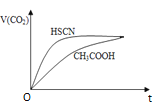
��Ӧ��ʼ��������Һ����CO2��������ʴ������Բ����ԭ���ǣ�________��Ӧ��������������Һ�У�c(SCN-)________c(CH3COO-)���> ������< ����= ��)
�� �������¶Ȳ��䣬�ڴ�����Һ�м���һ�������������������С����______������ţ���
a.c(CH3COO-�� b.c(H+) c.Kw d���������ƽ�ⳣ��
��2��úȼ�ղ���������Ҳ�������������CH4����ԭNOx�������������������Ⱦ����֪��CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=-867.0kJ mol-1
2NO2(g)![]() N2O4(g) ��H=-56.9kJ mol-1
N2O4(g) ��H=-56.9kJ mol-1
H2O(g)=H2O(l) ��H=-44.0kJ mol-1
д��CH4����ԭN2O4(g������N2(g)��CO2(g)��H2O(l)���Ȼ�ѧ����ʽ_________
��3������ȼ�ϵ�ؿ����������������ʡ���ͼ�����ü���ȼ�ϵ�ص��50mL 2mol/L���Ȼ�ͭ��Һ��װ��ʾ��ͼ����ش��������⣺
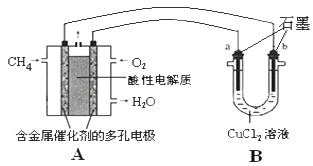
�ټ���ȼ�ϵ�صĸ�����Ӧʽ��____________
�� ��A������0.15mol����ʱ��B ��____������_______g��