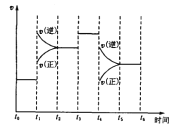
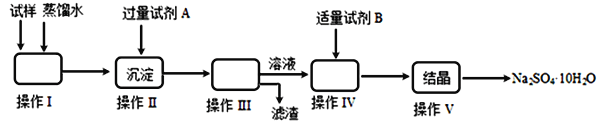
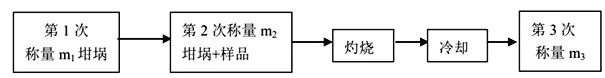
题目内容
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O

(1)该反应的平衡常数表达式K=____________________。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验。实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 3 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6 mL 3 mol·L-1 H2SO4 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是____________mL和____________mol·L-1。
②分析实验____________(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率。浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是__________________。
③加热有利于提高乙酯乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________________。
【答案】(1)![]()
(2)①6、6②A、C,浓H2SO4可以吸收酯化反应中生成的水,降低了生成物的浓度,使平衡向生成乙酸乙酯的方向移动③大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应
【解析】
试题分析:(1)达到平衡,生成物浓度的幂之积和反应物浓度的幂之积的比值是化学平衡常数,则根据方程式可知K=![]() ;
;
(2)①对照实验其他条件相同,因此应加入6mL6mol·L-1盐酸;
②根据勒夏特列原理,要求其他条件不变,浓硫酸吸水性影响实验,因此是A、C两个实验做对照实验,浓H2SO4可以吸收酯化反应中生成的水,降低了生成物的浓度使平衡向生成乙酸乙酯的方向移动;
③乙醇和乙酸易挥发,高温下有大量的乙醇和乙酸挥发,造成乙酸乙酯的产率降低。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案