题目内容
14.下列化学反应的离子方程式正确的是( )| A. | 氢氧化钡溶液于稀硫酸反应:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| C. | 常温下氯气与烧碱溶液反应:Cl2+2OH -═Cl-+ClO-+H2O | |
| D. | 实验室中氯气的制取:MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O |
分析 A.不符合离子的配比;
B.反应生成碳酸氢钙;
C.反应生成氯化钠、次氯酸钠和水;
D.浓盐酸与二氧化锰加热制备氯气,还生成氯化镁、水.
解答 解:A.氢氧化钡溶液于稀硫酸反应的离子反应为Ba2++2H++2OH-+SO42-═BaSO4↓+2H2O,故A错误;
B.往澄清石灰水中通入过量二氧化碳的离子反应为OH-+CO2═HCO3-,故B错误;
C.常温下氯气与烧碱溶液反应的离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故C正确;
D.实验室中氯气的制取的离子反应为MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O,故D正确;
故选CD.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应及氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图,当闭合开关K时,Y附近溶液先变红.下列说法正确的是( )
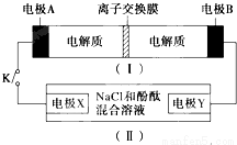

| A. | 闭合K时,X的电极反应式为:2H++2e-═H2↑ | |
| B. | 闭合K时,A电极反应式为:NiO2+2e-+2H+═Ni(OH)2 | |
| C. | 给装置(Ⅰ)充电时,B极参与反应的物质被氧化 | |
| D. | 给装置(Ⅰ)充电时,OH-通过阴离子交换膜,移向A电极 |
2.与17gNH3所含H原子数相同的是( )
| A. | 3molH2 | B. | 98gH2SO4 | C. | 标况下11.2LC2H6 | D. | 3.01×1023个HCl |
9.某有机物在氧气里充分燃烧,生成CO2和H2O的质量比为22:9,由此可得出的正确的结论是( )
| A. | 碳、氢、氧的原子个数比为1:2:3 | |
| B. | 碳、氢的原子个数比为1:2 | |
| C. | 该有机物中肯定不含氧元素 | |
| D. | 不能判断该有机物中是否含有氧元素 |
19.下列既能跟NaOH溶液反应、又能跟盐酸反应的是( )
| A. | Na2CO3溶液 | B. | CaCO3 | C. | NaHCO3溶液 | D. | Na2SO4溶液 |
6.质量分数不等的两种硫酸钠溶液等质量混合时,其质量分数为a%,而等体积混合后的质量分数为b%;
质量分数不等的两种乙醇溶液等质量混合时,其质量分数为a%,而等体积混合后的质量分数为c%.则
a、b、c的大小关系正确的是( )
质量分数不等的两种乙醇溶液等质量混合时,其质量分数为a%,而等体积混合后的质量分数为c%.则
a、b、c的大小关系正确的是( )
| A. | a>b>c | B. | b>a>c | C. | c>a>b | D. | c>a>b |
3.下列有关实验的说法正确的是( )
| 实验目的 | 实验方案 | |
| A | 检验碳与浓硫酸反应后的气体产物 | 将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 证明非金属性S>C | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 |
| A. | A | B. | B | C. | C | D. | D |
4.茉莉醛具有浓郁的茉莉花香,其结构简式如图所示:关于茉莉醛的下列叙述错误的是( )


| A. | 在一定条件下能与溴发生取代反应 | |
| B. | 能被高锰酸钾酸性溶液氧化 | |
| C. | 在加热和催化剂作用下,能与氢气反应 | |
| D. | 所有碳原子不可能共面且不能与氢溴酸发生加成反应 |