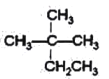
题目内容
【题目】既可以通过单质与单质化合,也可以通过溶液中的复分解反应来制得的化合物是( )
A.Na2O
B.Na2O2
C.FeCl2
D.FeS
【答案】D
【解析】解:A、Na2O在水溶液中生成氢氧化钠,所以不能通过溶液中的复分解反应而制得,故A错误;B、过氧化钠在水溶液中反应生成氢氧化钠和氧气,所以不能通过溶液中的复分解反应而制得,故B错误;
C、氯气是强氧化剂,将铁氧化成铁离子,所以不能通单质与单质化合制得,故C错误;
D、Fe和S化合生成FeS,也可由FeCl2和Na2S发生复分解反应得到,方程式为FeCl2+Na2S=FeS↓+2NaCl,故D正确;
故选D.

 阅读快车系列答案
阅读快车系列答案【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:______。
(2)联氨(N2H4)是一种还原剂,能与氧气反应生成氮气和水蒸气。试结合下表数据,写出在该反应的热化学方程式:____________________________。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:__________________________。
(4)常温下用氨水吸收CO2可得利(NH4)2CO3溶液,在(NH4)2CO3溶液中,c(OH-)_________c(H+)(填“>”“<”或“=”);反应NH4++CO32-+H2O![]() NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]() N2O4其相关图像如下。
N2O4其相关图像如下。
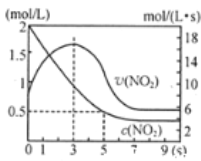
①0~3s时v(NO2)增大的原因是_________。
②5s时NO2转化率为__________。
【题目】下表列出了某短周期元素R的各级电离能数据(单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )
I1 | I2 | I3 | I4 | …… | |
R | 577.5 | 1816.7 | 2744.8 | 11577 |
①R的主要化合价中最高正价为+3价 ②R元素位于元素周期表中第ⅡA族
③R元素第一电离能小于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s22p1
A. ①② B. ②③ C. ③④ D. ①③