题目内容
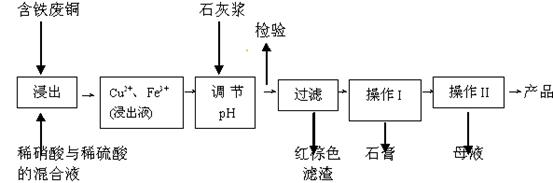
(11分)硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2 O)和副产物 石膏(CaSO4·2H2O)的生产流程示意图:
石膏(CaSO4·2H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
请回答下列问题:
(1)红棕色滤渣的主要成分是 ;
(2)写出浸出过程中生成硫酸铜的离子方程式 ;
(3)操作I包括蒸发浓缩、 等操作,温度应该控制在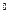 C左右;
C左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为 、 、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是 ;干燥时采用晾干,不用加热烘干的原因是 。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是 ;
②指出你认为不合理方案存在的问题是 。
 石膏(CaSO4·2H2O)的生产流程示意图:
石膏(CaSO4·2H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表。
温度(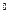 C) C) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红棕色滤渣的主要成分是 ;
(2)写出浸出过程中生成硫酸铜的离子方程式 ;
(3)操作I包括蒸发浓缩、 等操作,温度应该控制在
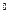 C左右;
C左右;(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为 、 、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是 ;干燥时采用晾干,不用加热烘干的原因是 。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是 ;
②指出你认为不合理方案存在的问题是 。
(1)Fe(OH)3
(2)3Cu+8H++2NO3— 3Cu2++2NO↑+4H2O
(3)趁热过滤 100 (4)冷却结晶 过滤 减少因晶体溶解而造成的损失 避免加热过程中晶体受热分解
(5)①方案二 ②Cu2+的蓝色对检验有干扰
(2)3Cu+8H++2NO3—
(3)趁热过滤 100 (4)冷却结晶 过滤 减少因晶体溶解而造成的损失 避免加热过程中晶体受热分解
(5)①方案二 ②Cu2+的蓝色对检验有干扰
略

练习册系列答案
相关题目
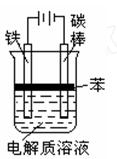
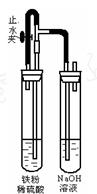
 。
。 右侧试管内可见到白色沉淀。
右侧试管内可见到白色沉淀。 6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移 mol电子。
6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移 mol电子。