��Ŀ����
����Ŀ��A��B��C��D��E��F���ֶ�����Ԫ�أ����ǵ�ԭ��������������A��Dͬ���壻C��Eͬ���壻B��Cͬ���ڣ�Bԭ���������������������������2��A�����ڱ��а뾶��С��Ԫ�أ�C���������������ڲ���ӵ�3����FԪ����ͬ����Ԫ����ԭ�Ӱ뾶��С������Ԫ�أ�A��B��C��D��E�γɵĻ�����ס��ҡ�����������������ʾ�� 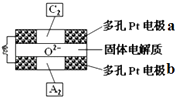
������ | �� | �� | �� | �� |
��ѧʽ | A2C | A2C2 | D2C2 | D2E |
�ش��������⣺
��1��ָ��Ԫ��F�����ڱ��е�λ�� ��
��2���������ҵĵ���ʽΪ �� �õ���ʽ��ʾ�γɻ����ﶡ�Ĺ���
��3��д�������Ӧ�����ӷ���ʽ�� ��
��4������������ȼ�ϵ�����Թ�������ﯩ�������Ϊ����ʣ����ֹ��������ڸ���������O2�������ͨ�����õ�صĹ���ԭ����ͼ��ʾ�����ж��Pt�缫a��b�ֱ�������C2��A2�����壮�õ�صĸ���Ϊ����a��b����O2������������������������õ�ص�������ӦʽΪ ��
���𰸡�
��1���������ڵڢ�A��
��2��![]() ��
��![]()
��3��2Na2O2+2H2O=4Na++4OH ��+O2��
��4��b������O2+4 e��=2O2��
���������⣺ԭ���������������A��B��C��D��E��F���ֶ�����Ԫ�أ�Bԭ���������������������������2��ԭ��ֻ����2�����Ӳ㣬����������Ϊ4����BΪ̼Ԫ�أ�A�����ڱ��а뾶��С��Ԫ�أ���AΪHԪ�أ�C���������������ڲ���ӵ�3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����CΪOԪ�أ�C��Eͬ���壬��EΪSԪ�أ�A��Dͬ���壬D��ԭ����������������DΪNa��F��ԭ�����������FԪ����ͬ����Ԫ����ԭ�Ӱ뾶��С������Ԫ�أ���FΪCl������֪��ΪH2O����ΪH2O2����ΪNa2O2����ΪNa2S.
��1.��Ԫ��FΪCl�������ڱ��е�λ�ã��������ڵڢ�A�壬���Դ��ǣ��������ڵڢ�A�壻
��2.����ΪH2O2 �� ����ʽΪ ![]() ���õ���ʽ��ʾ�γɻ�����Na2S�Ĺ��̣�
���õ���ʽ��ʾ�γɻ�����Na2S�Ĺ��̣� ![]() ��
��
���Դ��ǣ� ![]() ��
�� ![]() ��
��
��3.�������Ӧ�����ӷ���ʽ��2Na2O2+2H2O=4Na++4OH ��+O2����
���Դ��ǣ�2Na2O2+2H2O=4Na++4OH ��+O2����
��4.������������ȼ�ϵ�����Թ�������ﯩ�������Ϊ����ʣ����ֹ��������ڸ���������O2�������ͨ�����õ�صĹ���ԭ����ͼ��ʾ�����ж��Pt�缫a��b�ֱ�������O2��H2�����壬��������������Ӧ�������ڸ���ʧȥ���ӣ��õ�صĸ���Ϊb��O2������������������ԭ��Ӧ��������������õ������������ӣ��õ�ص�������ӦʽΪ��O2+4 e��=2O2�� �� ���Դ��ǣ�b������O2+4 e��=2O2�� ��